
| A. | ①②③ | B. | ②③⑤ | C. | ④⑤ | D. | ④⑤⑥ |
分析 醋酸是弱酸,加水稀釋促進醋酸電離,溶液中c(H+)、c(CH3COO-)都減小,溫度不變,水的離子積常數不變,則溶液中c(OH-)增大.
解答 解:①醋酸是弱酸,加水稀釋促進醋酸電離,水的電離增大程度小于溶液體積增大程度,所以溶液中c(H+)減小,故①錯誤;
②加水稀釋促進醋酸電離,導致溶液中n(H+)增大,故②正確;
③加水稀釋促進醋酸電離,則N(H+)增大、N(CH3COOH)減小,所以$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故③正確;
④根據③知,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$減小,故④錯誤;
⑤加水稀釋促進醋酸電離,溶液中c(H+)、c(CH3COO-)都減小,溫度不變,水的離子積不變,則溶液中c(OH-)增大,故⑤正確;
⑥加水稀釋促進醋酸電離,水的電離增大程度小于溶液體積增大程度,所以溶液中c(CH3COO-)減小,故⑥錯誤;
故選B.
點評 本題考查了弱電解質的電離,明確弱電解質電離特點是解本題關鍵,根據醋酸電離程度與溶液體積增大程度之間的關系結合水的離子積常數來分析解答,很多同學往往認為“增大醋酸電離程度,則溶液中氫離子濃度增大”而導致錯誤,為易錯點題.


科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
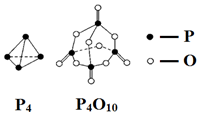
| A. | -(6a-12b-4c+5d)kJ•mol-1 | B. | -(-6a+12b+4c-5d)kJ•mol-1 | ||
| C. | -(-4a+6b+4c-5d)kJ•mol-1 | D. | -(4a-6b-4c+5d)kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣可用于自來水消毒 | |
| B. | 40%的甲醛水溶液可用作防腐劑,浸制生物標本 | |
| C. | 工業酒精可用于釀造飲用酒 | |
| D. | 食鹽中添加碘酸鉀(KIO3)加工碘鹽 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 用已知濃度的NaOH溶液測定H2SO4溶液的濃度,所選用的滴定管如圖甲、乙所示,從下表中選出正確選項( )
用已知濃度的NaOH溶液測定H2SO4溶液的濃度,所選用的滴定管如圖甲、乙所示,從下表中選出正確選項( )| 錐形瓶中的溶液 | 滴定管中的溶液 | 選用指示劑 | 選用滴定管 | |
| A. | 堿 | 酸 | 石蕊 | 乙 |
| B. | 酸 | 堿 | 酚酞 | 甲 |
| C. | 堿 | 酸 | 甲基橙 | 乙 |
| D. | 酸 | 堿 | 酚酞 | 乙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
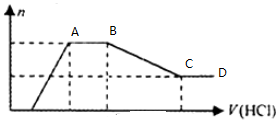
| A. | 溶液X中一定不含Cu2+、Mg2+、Al3+,可能含有Cl- | |
| B. | OA段參加反應的陰離子的物質的量之比為2:1或1:2 | |
| C. | AB段一定生成了氣體 | |
| D. | BC段發生反應的離子方程式為:Al(OH)3+3H+=Al3++3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | X | Y | Z | Q |
| 時間 | ||||
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com