
分析 草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性.向10mL 0.01mol•L-1的H2C2O4溶液滴加0.01mol•L-1KOH溶液V(mL);
(1)當V<10mL時,H2C2O4和KOH反應生成HC2O4 -,還有草酸多余;
(2)當V=10mL時,H2C2O4和KOH反應生成KHC2O4 -,KHC2O4溶液呈酸性說明溶液中電離大于水解,比較溶液中HC2O4-、C2O42-、H2C2O4、H+的濃度從大到小的順序;
(3)當V=amL時,溶液中離子濃度有如下關系:c(K+)=2c(C2O42-)+c(HC2O4-),依據溶液中電荷守恒分析氫離子濃度和氫氧根離子濃度相同判斷;
當V=bmL時,溶液中離子濃度有如下關系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)是溶液中物料守恒分析,溶質為KHC2O4;
(4)當V=20mL時,反應生成K2C2O4,再滴入NaOH溶液,抑制鹽類的水解,n(C2O42-)的值將增大.
解答 解:(1)當V<10mL時,H2C2O4和KOH反應生成HC2O4 -,還有草酸多余,反應的離子方程式為:H2C2O4+OH-=HC2O4-+H2O;
故答案為:H2C2O4+OH-=HC2O4-+H2O;
(2)當V=10mL時,H2C2O4和KOH反應生成HC2O4-,KHC2O4溶液呈酸性說明溶液中電離大于水解,比較溶液中HC2O4-、C2O42-、H2C2O4、H+的濃度從大到小的順序為:c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4);
故答案為:c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4);
(3)當V=amL時,溶液中離子濃度有如下關系:c(K+)=2c(C2O42-)+c(HC2O4-),依據溶液中電荷守恒分析氫離子濃度和氫氧根離子濃度相同判斷,溶液中溶質為KHC2O4和為K2C2O4;當V=bmL時,溶液中離子濃度有如下關系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)是溶液中物料守恒分析,溶質為KHC2O4,說明a大于b,
故答案為:>;
(4)當V=20mL時,反應生成K2C2O4,再滴入NaOH溶液,抑制鹽類的水解,n(C2O42-)的值將增大,所以$\frac{c(H{C}_{2}{{O}_{4}}^{-})}{c({C}_{2}{{O}_{4}}^{2-})}$的值變小,
故答案為:變小.
點評 本題考查了時間混合的定性判斷及溶液中離子濃度大小比較方法,題目難度中等,注意掌握酸堿中和反應中過量情況的判斷與計算方法,能夠根據電荷守恒、物料守恒、鹽的水解原理判斷溶液中離子濃度大小.


科目:高中化學 來源: 題型:選擇題
| A. | pH=11的氨水與pH=3的鹽酸等體積混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | 0.2mol/L的CH3COOH溶液與0.1mol/L的NaOH溶液等體積混合:2c(Na+)=c(CH3COO-) | |
| C. | 濃度均為0.10mol/L的氨水和氯化銨溶液等體積混合后:c(NH3•H2O)+c(NH4+)=0.1mol/L | |
| D. | pH=3的鹽酸和pH=11的氫氧化鋇等體積混合pH>7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
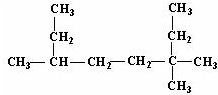 的名稱為3,3,6-三甲基辛烷;
的名稱為3,3,6-三甲基辛烷;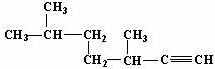 的名稱為3,6-二甲基-1-庚炔;
的名稱為3,6-二甲基-1-庚炔;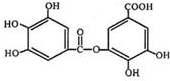 中含氧官能團的名稱為羥基、羧基、酯基.
中含氧官能團的名稱為羥基、羧基、酯基.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
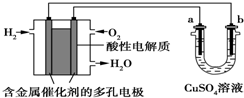
| A. | 燃料電池工作時,正極反應:O2+2H2O+4e-═4OH- | |
| B. | a極是鐵,b極是銅時,b極逐漸溶解,a極上有銅析出 | |
| C. | a極是粗銅,b極是純銅時,隨著反應的進行濃度減小 | |
| D. | a、b兩極均是石墨時,在相同條件下b極產生的氣體與電池中消耗的H2體積相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 第六周期第ⅢA族的元素Tl,其氫氧化物的堿性比Al(OH)3弱 | |
| B. | 鹵族元素At的單質為有色固體,AgAt可能不溶于水也不溶于稀硝酸 | |
| C. | Li與水反應比鈉與水反應劇烈 | |
| D. | H2Se是無色,有毒,比H2S穩定的氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由乙醇制乙烯是放熱反應 | |
| B. | 氟氯代烷是一類含氟和含氯的鹵代烴 | |
| C. | 木糖醇的結構簡式為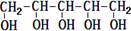 ,由此可見它能發生酯化反應,難溶于水 ,由此可見它能發生酯化反應,難溶于水 | |
| D. | 淀粉和纖維素的分子式都是(C6H10O5)n,所以二者是同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸銅使菌體蛋白質鹽析 | |
| B. | 石灰乳使菌體蛋白質水解 | |
| C. | 銅離子在堿性條件下使菌體蛋白質變性 | |
| D. | 蛋白質可以溶解波爾多液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com