
| 2.5cVmol×34g/mol |
| ag |
| 8.5cV |
| a |
| 8.5cV |
| a |


科目:高中化學 來源: 題型:
| A、v(A)=0.15 mol?L-1?min-1 |
| B、v(B)=0.015 mol?L-1?s-1 |
| C、v(C)=0.40 mol?L-1?min-1 |
| D、v(D)=0.45 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
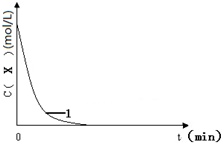 已知:將KI、鹽酸、試劑X和淀粉四種溶液混合,無反應發生.若再加入雙氧水,將發生反應:H2O2+2H++2I-═2H2O+I2,且生成的I2立即與試劑X反應而被消耗.一段時間后,試劑X將被反應生成的I2完全消耗.由于溶液中的I-繼續被H2O2氧化,生成的I2與淀粉作用,溶液立即變藍.因此,根據試劑X的量、滴入雙氧水至溶液變藍所需的時間,即可推算反應H2O2+2H++2I-═2H2O+I2的反應速率.
已知:將KI、鹽酸、試劑X和淀粉四種溶液混合,無反應發生.若再加入雙氧水,將發生反應:H2O2+2H++2I-═2H2O+I2,且生成的I2立即與試劑X反應而被消耗.一段時間后,試劑X將被反應生成的I2完全消耗.由于溶液中的I-繼續被H2O2氧化,生成的I2與淀粉作用,溶液立即變藍.因此,根據試劑X的量、滴入雙氧水至溶液變藍所需的時間,即可推算反應H2O2+2H++2I-═2H2O+I2的反應速率.| 編號 | 往燒杯中加入的試劑及其用量(mL) | 催化劑 | 開始變藍時間(min) | ||||
| 0.1 mol?L-1 KI溶液 | H2O | 0.01 mol?L-1 X 溶液 | 0.1 mol?L-1 雙氧水 | 1 mol?L-1 稀鹽酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 無 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 無 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 無 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
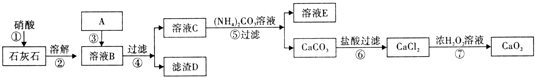
| 氣化爐中產生H2 |
| 通入水蒸氣,主要化學反應: ①C(s)+H2O(g)═CO(g)+H2(g) △H=+131.6kJ mol-1 ②CO(g)+H2O(g)═CO2(g)+H2(g) △H=-41.2kJ mol-1 ③CaO(s)+CO2(g)═CaCO3(s) △H=-178.3kJ mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 實驗操作 | 現象和結論 |
| 步驟1:取少許樣品于試管中,加入適量蒸餾水充分溶解,再滴加H2SO4酸化的KMnO4溶液; | 現象:若KMnO4溶液的紫紅色褪為無色 ①結論:樣品中有 ②褪色的離子方程式為: |
| 步驟2:另取少許樣品于試管中,加入適量蒸餾水充分溶解,再滴加稀HCl,使溶液呈酸性,再滴加適量BaCl2溶液; | ③現象:若 結論:假設2成立. |
| … | … |
查看答案和解析>>
科目:高中化學 來源: 題型:
 某興趣小組同學進行乙醛的銀鏡反應實驗的操作步驟如下:
某興趣小組同學進行乙醛的銀鏡反應實驗的操作步驟如下:| 實驗變量 實驗序號 | 銀氨溶液的量/mL | 乙醛的量/滴 | 溫度/℃ | 反應混合液的pH | 出現銀鏡的時間/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、CH3CH2OH、SO3和水分別屬于非電解質、強電解質和弱電解質 |
| B、為測定熔融氫氧化鈉的導電性,可將氫氧化鈉固體放在石英坩堝中加熱熔化 |
| C、煤油可由石油分餾獲得,可用于保存少量金屬鈉 |
| D、工業上金屬Mg、Al都是用電解其相應的氯化物水溶液制得的 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com