
分析 (1)①根據電池反應式知,充電時,鈉離子得電子發(fā)生還原反應,所以鈉作陰極,應該連接電源負極;
②放電時,硫為正極發(fā)生還原反應;
③電解NaCl溶液生成氫氣、氯氣和氫氧化鈉;根據少什么加什么結合轉移電子數相等判斷計算;
④在一鐵片上鍍銅,銅作陽極,鐵作陰極應與負極相連;
(2)根據電池總反應為2Ag+Cl2═2AgCl可知,Ag失電子作負極失電子,氯氣在正極上得電子生成氯離子,據此分析解答.
解答 解:(1)①根據電池反應式知,充電時,鈉離子得電子發(fā)生還原反應,所以鈉作陰極,應該連接電源負極;陰極上失電子發(fā)生氧化反應,電極反應式為Na2Sx-2e-=xS+2Na+ 或Sx2--2e-=xS,
故答案為:負;Na2Sx-2e-=xS+2Na+ 或Sx2--2e-=xS;
②放電時,硫得電子發(fā)生還原反應作正極,故答案為:硫;
③電解NaCl溶液生成氫氣、氯氣和氫氧化鈉,離子方程式為:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$2OH-+H2↑+Cl2↑,電解本質為電解HCl,根據少什么加什么結合轉移電子數相等,所以若要使溶液完全恢復到起始濃度,可向溶液中加入氯化氫,其質量約為$\frac{23g}{23g/mol}$×36.5g/mol=36.5g,故答案為:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$2OH-+H2↑+Cl2↑;氯化氫;36.5g;
④在一鐵片上鍍銅,銅作陽極,鐵作陰極應與負極相連,所以若用該鈉硫電池作電源在一鐵片上鍍銅,此鐵片與負極鈉相連,故答案為:鈉;
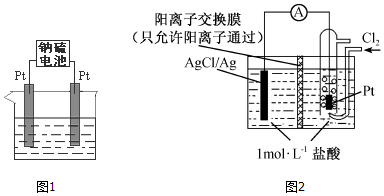
(2)①放電時,交換膜左側的氫離子向右側移動,在負極上有銀離子生成,銀離子在左側和氯離子反應生成AgCl沉淀,故答案為:有大量白色沉淀生成;
②放電時,當電路中轉移0.01mol e-時,交換膜左則會有0.01mol氫離子通過陽離子交換膜向正極移動,有0.01mol氯離子反應生成AgCl白色沉淀,所以交換膜左側溶液中約減少0.02 mol離子,故答案為:0.02;
③該電池的能量轉化的主要形式為化學能轉化為電能,故答案為:化學能轉化為電能.
點評 本題考查化學電源新型電池,為高頻考點,明確各個電極上發(fā)生的反應是解本題關鍵,難點是電極反應式的書寫,題目難度不大.


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:選擇題
| A. | v(D)=0.01 mol/(L•s) | B. | v(C)=0.8 mol/(L•min) | ||
| C. | v(B)=0.02 mol/(L•s) | D. | v(A)=0.5 mol/(L•min) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某無色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | Fe2+與H2O2在酸性溶液中的反應:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| C. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| D. | 稀硫酸和氫氧化鋇溶液反應:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | p(He)>p(H2)>p(N2) | B. | p(H2)>p(He)>p(N2) | C. | p(H2)>p(N2)>p(He) | D. | p(N2)>p(He)>p(H2) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.15mol/L | B. | 0.10mol/L | C. | 0.25mol/L | D. | 0.40mol/L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com