
 將一定質量的鎂鋁合金投入200mL 一定濃度的鹽酸中,合金完全溶解.
將一定質量的鎂鋁合金投入200mL 一定濃度的鹽酸中,合金完全溶解.分析 (1)NaOH溶液0-40 mL區間沒有生成沉淀,說明鹽酸有剩余,剩余的鹽酸與氫氧化鈉溶液反應生成氯化鈉和水;
(2)NaOH溶液160-180mL區間沉淀溶解,發生反應為氫氧化鋁與氫氧化鈉溶液反應生成偏鋁酸鈉和水;
(3)從加入40m氫氧化鈉溶液開始產生沉淀,加入氫氧化鈉溶液為160mL時,沉淀量最大,此時沉淀為Mg(OH)2和Al(OH)3,反應后溶質為氯化鈉;
(4)根據圖象可知,16.5g沉淀為氫氧化鋁和氫氧化鎂的混合物,7.8g為氫氧化鎂,根據n=$\frac{m}{M}$計算出氫氧化鎂的物質的量,再根據質量守恒定律得出Mg的物質的量,最后根據m=nM計算出Mg的質量;
(5)加入氫氧化鈉溶液為160mL時,沉淀量最大,此時為Mg(OH)2和Al(OH)3,溶液為氯化鈉溶液,根據鈉元素守恒此時溶液中n(NaCl)=n(NaOH),據此計算出n(HCl),再利用c=$\frac{n}{V}$計算鹽酸的物質的量濃度.
解答 解:(1)由圖可知,從開始至加入NaOH溶液40mL,沒有沉淀生成,說明原溶液中鹽酸溶解Mg、Al后鹽酸有剩余,此時發生的反應為:HCl+NaOH=NaCl+H2O,離子方程式為H++OH-=H2O,
故答案為:H++OH-=H2O;
(2)NaOH溶液160-180mL區間沉淀部分溶解,發生反應為:Al(OH)3+NaOH=NaAlO2+2H2O,其離子方程式為:OH-+Al(OH)3=AlO2-+2H2O,
故答案為:OH-+Al(OH)3=AlO2-+2H2O;
(3)根據圖象曲線變化可知,加入40m氫氧化鈉溶液開始產生沉淀,加入氫氧化鈉溶液為160mL時,沉淀量最大,此時為Mg(OH)2和Al(OH)3,反應后溶質為NaCl,
故答案為:NaCl;
(4)加入氫氧化鈉溶液為160mL時,沉淀量最大,此時為Mg(OH)2和Al(OH)3,根據圖象可知,氫氧化鋁和氫氧化鎂的總質量為16.5g,
加入180mL氫氧化鈉溶液時,剩余的8.5g沉淀為氫氧化鎂,n[Mg(OH)2]=$\frac{7.8g}{58g/mol}$=0.15mol
由元素守恒可知:n(Mg)=n[Mg(OH)2]=0.15mol,
所以Mg的質量為:0.15mol×24g/mol=3.6g,
故答案為:3.6;
(5)加入氫氧化鈉溶液為160mL時,沉淀量最大,此時為Mg(OH)2和Al(OH)3,溶液為NaCl溶液,
根據鈉元素守恒此時溶液中:n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,
根據氯元素守恒n(HCl)=0.8mol,
故鹽酸的物質的量濃度為:$\frac{0.8mol}{0.1L}$=8mol/L,
答:鹽酸的物質的量濃度為8mol/L.
點評 本題考查鎂鋁化合物性質、混合物的計算,題目難度中等,以圖象題的形式考查,增加了試題難度,分析圖象各階段的發生的反應是解題關鍵,再利用守恒計算,試題培養了學生的化學計算能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 合成氨的化學反應限度最大 | |
| B. | N2的轉化率最高 | |
| C. | 催化劑的活性最大 | |
| D. | NH3在平衡混合氣體中的體積分數最大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
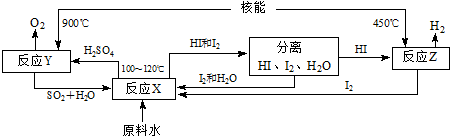
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 都能使品紅試液褪色 | |
| B. | 都能和氫氧化鈉溶液反應生成鹽和水 | |
| C. | 都有刺激性氣味 | |
| D. | 常溫下都是氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
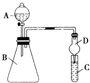 某同學為探究元素周期表中元素性質的遞變規律,設計了如下系列實驗:
某同學為探究元素周期表中元素性質的遞變規律,設計了如下系列實驗:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
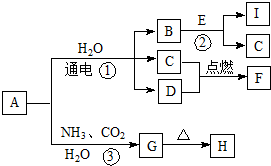 中學化學中的一些常見物質有下圖轉化關系(部分產物未給出).其中A的焰色呈黃色,D常溫下為黃綠色氣體,反應③為侯氏制堿法反應原理之一,E是常見的金屬.
中學化學中的一些常見物質有下圖轉化關系(部分產物未給出).其中A的焰色呈黃色,D常溫下為黃綠色氣體,反應③為侯氏制堿法反應原理之一,E是常見的金屬.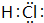 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 自然界里沒有任何一種食物能同時滿足人體對各種維生素的需要 | |
| B. | 用于2008年北京奧運“祥云”火炬的丙烷是一種清潔燃料 | |
| C. | 用大米釀的酒在一定條件下密封保存,時間越長越香醇 | |
| D. | 葡萄糖、蔗糖、纖維素和脂肪在一定條件下都可以發生水解反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com