
分析 (1)向沸水中滴入幾滴飽和FeCl3溶液,繼續(xù)煮沸至溶液呈紅褐色,即制得Fe(OH)3膠體;氫氧化鐵膠體的制備實質是氯化鐵的水解;膠體特有的性質是丁達爾效應;
(2)Fe(OH)3膠粒帶正電,故向陰極移動,陰極顏色變深,此為膠體的電泳;
(3)電解質溶液能使膠體發(fā)生聚沉;
(4)滴入過量的稀硫酸,會先導致膠體的聚沉,生成Fe(OH)3沉淀,后過量的硫酸能使Fe(OH)3沉淀溶解;
(5)膠體的提純用滲析.
解答 解:(1)實驗室制備氫氧化鐵膠體原理是在加熱條件下,三價鐵離子水解生成氫氧化鐵膠體,其操作為:向沸水中逐滴加入FeCl3溶液;繼續(xù)加熱至溶液呈紅褐色,停止加熱,即得到Fe(OH)3 膠體;化學方程式為:FeCl3+3H2O$\frac{\underline{\;加熱\;}}{\;}$Fe(OH)3+3HCl;膠體特有的性質是丁達爾效應,故用光束照射溶液,如果有丁達爾效應,則說明膠體已制成.故答案為:向沸水中逐滴加入FeCl3溶液;繼續(xù)加熱至溶液呈紅褐色,停止加熱,即得到Fe(OH)3 膠體;FeCl3+3H2O$\frac{\underline{\;加熱\;}}{\;}$Fe(OH)3+3HCl;用光束照射溶液,如果有丁達爾效應,則說明膠體已制成;
(2)Fe(OH)3膠粒帶正電,故用石墨電極接通直流電,通電一段時間后,Fe(OH)3膠粒向陰極移動,陰極顏色變深,此為膠體的電泳,故答案為:加深;Fe(OH)3膠粒帶正電;電泳;
(3)向膠體中加入飽和(NH4)2SO4溶液后會生成Fe(OH)3沉淀,原因是電解質溶液能使膠體發(fā)生聚沉,故答案為:生成沉淀,電解質溶液能使膠體發(fā)生聚沉;
(4)由于稀硫酸是電解質溶液,故開始滴入稀硫酸,會導致膠體的聚沉,生成Fe(OH)3沉淀,后過量的硫酸能使Fe(OH)3沉淀溶解,故答案為:先生成沉淀,后沉淀消失;膠體先遇稀硫酸發(fā)生膠體的聚沉,后稀硫酸將生成的氫氧化鐵沉淀溶解;
(5)膠體的提純用滲析,故答案為:滲析.
點評 本題考查了Fe(OH)3 膠體的制備和膠體的性質,題目難度不大,易錯點為膠體的制備原理,注意制備方法.


科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 實驗目的 |
| A | 向含有KSCN溶液的FeSO4溶液中滴加硫酸酸化的H2O2溶液 | 檢驗H2O2的氧化性大于Fe3+ |
| B | 將氣體通入稀溴水中 | 檢驗SO2 中是否混有乙烯 |
| C | 滴入紫色石蕊試液 | 檢驗酒精中是否混有醋酸 |
| D | 用飽和碳酸鈉溶液洗滌后分液 | 除去乙酸乙酯中少量的乙醇和乙酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 二氧化氯被世界衛(wèi)生組織(WHO)確認為第四代A1型消毒劑.
二氧化氯被世界衛(wèi)生組織(WHO)確認為第四代A1型消毒劑.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 配制0.1mol•L-1 NaOH溶液時,用潮濕的燒杯稱量NaOH固體,對配制結果無影響 | |
| B. | 配制一定物質的量濃度溶液時,用量筒量取濃溶液體積仰視讀數,所配溶液的濃度結果偏高 | |
| C. | 98%的濃硫酸用等體積的水稀釋后,硫酸的質量分數為49% | |
| D. | 溫度一定時,向飽和食鹽水中加入固體氯化鈉,則溶液的濃度和質量均不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | W10O21 | B. | W8O22 | C. | W10O27 | D. | W5O14 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
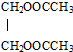 (過程中無機產物已忽略)
(過程中無機產物已忽略) .
.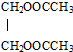 的反應方程式CH3COOH+HOCH2CH2OH$→_{△}^{濃H_{2}SO_{4}}$
的反應方程式CH3COOH+HOCH2CH2OH$→_{△}^{濃H_{2}SO_{4}}$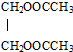 +2H2O.
+2H2O.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com