
【題目】已知無水FeCl3能與氯苯反應:2FeCl3+C6H5Cl=2FeCl2+C6H4Cl2+HCl↑,實驗室利用該裝置制備無水FeCl2并檢測FeCl3的轉化率。已知:C6H5Cl、C6H4Cl2沸點依次為132℃、173℃。如圖為制備FeCl2裝置(加熱和加持儀器省略)
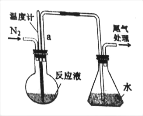
(1)蒸干并灼燒FeCl2溶液最終得到_____
(2)導管a的作用是_____;反應前通入N2的作用是_____;
(3)錐形瓶的作用是_____;該裝置的不足之處為_____。
(4)反應結束后,回收過量氯苯的操作方法名稱是_____。
若32.500g無水FeCl3與過量氯苯充分反應后將錐形瓶內溶液配制成250mL溶液,量取其中25.00mL溶液,滴加指示劑后,用0.4000mol/L的NaOH溶液滴定,重復三次,達到滴定終點平均消耗19.60mLNaOH溶液。
(5)滴定終點的現象是_____。
(6)FeCl3的轉化率(轉化量占總量的百分率)為_____%。
若制備反應后未通入足量N2,測定結果會_____(選項:偏高、偏低或不影響)
【答案】Fe2O3 導氣,冷凝回流 除盡 O2 吸收HCl氣體 無防倒吸裝置 蒸餾 滴入最后一滴 NaOH,溶液恰好變成紅色,且半分鐘內不褪色 78.4% 偏低
【解析】
(1) FeCl2易被氧化為FeCl3,加熱蒸干促進FeCl3水解;
(2) 2FeCl3+C6H5Cl=2FeCl2+C6H4Cl2+HCl↑反應生成HCl氣體,反應物C6H5Cl沸點較低;FeCl2具有還原性,易被氧氣氧化;
(3)錐形瓶內的水吸收導管a排出的HCl氣體;HCl易溶于水,引起倒吸;
(4)根據氯苯的沸點較低分析回收過量氯苯的方法;
(5)錐形瓶內的溶液為鹽酸,滴入氫氧化鈉,溶液pH逐漸增大;
(6)根據關系式2FeCl3~~~HCl~~~NaOH,計算FeCl3的轉化率;若制備反應后未通入足量N2,則燒瓶內的HCl不能完全溶于錐形瓶內的水中。
(1) FeCl2被氧化為FeCl3,加熱蒸干FeCl3水解為Fe(OH) 3灼燒分解為Fe2O3;
(2) 2FeCl3+C6H5Cl=2FeCl2+C6H4Cl2+HCl↑反應生成HCl氣體,反應物C6H5Cl沸點較低,所以導管a的作用是導出HCl氣體、冷凝回流C6H5Cl;FeCl2具有還原性,易被氧氣氧化,反應前通入N2,除盡裝置中的O2;
(3)錐形瓶內的水吸收導管a排出的HCl氣體,錐形瓶的作用是吸收HCl氣體;HCl易溶于水,引起倒吸,該裝置的不足之處為無防倒吸裝置;
(4)氯苯的沸點較低,用蒸餾的方法回收過量氯苯;
(5)錐形瓶內的溶液為鹽酸,用酚酞作指示劑,滴入氫氧化鈉,溶液pH逐漸增大,滴定終點的現象是滴入最后一滴 NaOH,溶液恰好變成紅色,且半分鐘內不褪色;
(6)根據關系式2FeCl3~~~HCl~~~NaOH,參加反應的反應FeCl3的物質的量是![]() ,32.500g無水FeCl3的物質的量是0.2mol,FeCl3的轉化率是
,32.500g無水FeCl3的物質的量是0.2mol,FeCl3的轉化率是![]() 78.4%;
78.4%;
若制備反應后未通入足量N2,則反應生成的HCl不能完全溶于錐形瓶內的水中,所以測定結果會偏低。


 導學教程高中新課標系列答案
導學教程高中新課標系列答案 小學課時特訓系列答案
小學課時特訓系列答案科目:高中化學 來源: 題型:
【題目】在下圖點滴板上進行四個溶液間反應的小實驗,其對應反應的離子方程式書寫正確的是( )

A. a反應:Fe2++2H++H2O2=Fe3++2H2O
B. b反應:HCO3-+OH-=CO32-+H2O
C. c反應:H++OH-=H2O
D. d反應:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X、Y、Z、W、M均為短周期主族元素。25℃時,各元素最高價氧化物對應的水化物溶液(濃度均為0.01mol/L)的pH和原子半徑的關系如圖所示。下列說法不正確的是( )
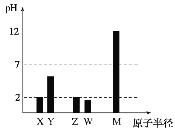
A. 從圖中得出同濃度下W的最高價氧化物對應的水化物的pH比Z小,故非金屬性:W>Z
B. X、Z的最簡單氣態氫化物在常溫下可以反應生成離子化合物
C. X、Y、Z、W、M五種元素單質中Y常見單質熔點最高
D. 簡單離子半徑大小順序:X>M
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙、丁是中學化學常見物質,它們有如圖轉化關系(反應條件和其它產物省略),有關描述錯誤的是
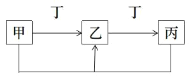
A.若甲為氫氧化鈉溶液,則丁可能為二氧化碳
B.若乙為淡黃色固體,則丙一定為二氧化硫
C.若乙為兩性氫氧化物,則丁溶液可能堿性
D.若丁是鐵單質,則甲一定為氯氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaClO、NaNO3、Na2SO3等鈉鹽在多領域有著較廣的應用。
(1)上述三種鹽所涉及的五種元素中,半徑較小的原子是______________;原子核外最外層p亞層上電子自旋狀態只有一種的元素是_____________。
(2)堿性條件下,鋁粉可除去工業廢水中的NaNO2,處理過程中產生一種能使濕潤紅色石蕊試紙變藍的氣體。產物中鋁元素的存在形式_____________(填化學符號);每摩爾鋁粉可處理_____________gNaNO2。
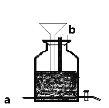
(3)新冠疫情發生后,有人用電解食鹽水自制NaClO消毒液,裝置如圖(電極都是石墨)。電極a應接在直流電源的_____________極;該裝置中發生的化學方程式為_____________
(4)Na2SO3溶液中存在水解平衡![]() +H2O
+H2O![]()
![]() +
+![]() 設計簡單實驗證明該平衡存在__________________。0.1mol/L Na2SO3溶液先升溫再降溫,過程中(溶液體積變化不計)PH如下。
設計簡單實驗證明該平衡存在__________________。0.1mol/L Na2SO3溶液先升溫再降溫,過程中(溶液體積變化不計)PH如下。
時刻 | ① | ② | ③ | ④ |
溫度/℃ | 25 | 30 | 40 | 25 |
PH | 9.66 | 9.52 | 9.37 | 9.25 |
升溫過程中PH減小的原因是_____________;①與④相比;C(![]() )①____________④(填“>”或“<”).
)①____________④(填“>”或“<”).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,A、F為石墨電極,B、E為鐵片電極。按要求回答下列問題。

(1)打開K2,合并K1。A的電極反應為________。最終可觀察到的現象是________________。
(2)打開K1,合并K2。F極的電極反應為_______,檢驗F極產生氣體的方法是____________。
(3)若往U形管中滴加酚酞,進行(1)(2)操作時,A、B、E、F電極周圍能變紅的是_____,原因是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁及其化合物在生產生活中具有重要的作用。
(1)鋁屬于活潑金屬卻能在空氣中穩定存在,原因是(用化學用語及相關文字說明)___________
(2)鋁電池性能優越,在現代生產、生活中有廣泛的應用。鋁-空氣電池以其環保、安全而受到越來越多的關注,其原理如下圖所示。
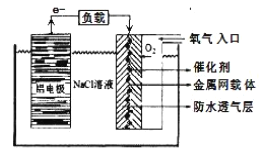
該電池的正極反應方程式為 _____;電池中NaCl溶液的作用是 ______;以該電池為電源,用惰性電極電解Na2SO4溶液,當Al電極質量減少1.8g時,電解池陰極生成的氣體在標準狀況下的體積為_______L。
(3)AlCl3與NaN3在高溫下反應可制得高溫結構陶瓷氮化鋁(AlN),且生成N2。NaN3晶體中陰、陽離子個數比為______,寫出反應化學方程式為___________
(4)同主族的元素應用廣泛。2019年1月3日上午,嫦娥四號探測器翩然落月,首次實現人類飛行器在月球背面的軟著陸。所搭載的“玉兔二號”月球車,通過砷化鎵(GaAs)太陽能電池提供能量進行工作。回答下列問題:
①基態Ga原子價電子排布式____,核外電子占據最高能級的電子云形狀為____;基態As原子最高能層上有____個電子。
②鎵失去電子的逐級電離能(單位:kJ/mol)的數值依次為577、1985、2962、6192,-1由此可推知鎵的主要化合價為_____和+3,砷的第一電離能比鎵_____填“大”或“小”)。
③第四周期元素中,與基態As原子核外未成對電子數目相同的元素符號為____。
④砷化鎵可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的雜化方式為 ______,AsH3分子的空間構型為______。
⑤相同壓強下,AsH3的沸點_______NH3(填“大于”或“小于”),原因為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵是應用最廣泛的金屬,鐵的鹵化物、氧化物以及高價鐵的含氧酸鹽均為重要化合物。
(1)要確定鐵的某氯化物FeClx的化學式。可用離子交換和滴定的方法。實驗中稱取0.54g的FeClx樣品,溶解后先進行陽離子交換預防處理,再通過含有飽和OH-的陰離子交換柱,使Cl-和OH-發生交換。交換完成后,流出溶液的OH-用0.40mol·L-1的鹽酸滴定,滴至終點時消耗鹽酸25.0mL。計算該樣品中氯的物質的量,并求出FeClx中x值______
(2)現有一含有FeCl2和FeCl3的混合樣品,采用上述方法測得n(Fe): n(Cl)=1:2.1,則該樣品中FeCl3的物質的量分數為____。在實驗室中,FeCl2可用鐵粉和____反應制備,FeCl3可用鐵粉和_______反應制備
(3)FeCl3與氫碘酸反應時可生成棕色物質,該反應的離子方程式為____________
(4)高鐵酸鉀(K2FeO4)是一種強氧化劑,可作為水處理劑和高容量電池材料。FeCl3與KClO在強堿性條件下反應可制取K2FeO4,其反應的離子方程式為________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表給出了六種元素的相關信息,其中A、B、C、D、E、F為短周期元素,原子序數依次遞增。
元素 | 相關信息 |
A | 單質為密度最小的氣體 |
B | 元素最高正價與最低負價之和為0 |
D | 可形成D2、D3兩種氣態單質,其中一單質是保護地球地表環境的重要屏障 |
E | 存在質量數為23,中子數為12的核素 |
F | 單質F為淡黃色固體 |
根據上述信息填空:
(1)元素D在元素周期表中的位置是____________。E基態原子的電子排布式_______________________。
(2)化合物甲是一種強氧化劑,由元素D和E組成,寫出一種甲的用途:_______________,
書寫化合物甲與BD2的反應式并標出電子轉移情況:_______________。
(3)化合物乙由元素D和F組成,氣體乙與A2F反應的化學方程式是______________。化合物乙的危害_______________________。(寫一種)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com