
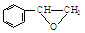 或
或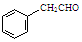 ,某種咔咯鐵的配合物能將溫室氣體CO2轉化為CO${\;}_{3}^{2-}$和CO.
,某種咔咯鐵的配合物能將溫室氣體CO2轉化為CO${\;}_{3}^{2-}$和CO.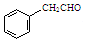 分子中碳原子軌道的雜化類型是sp2、sp3,1mol
分子中碳原子軌道的雜化類型是sp2、sp3,1mol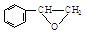 分子中含有σ鍵的數目為18mol.
分子中含有σ鍵的數目為18mol.
分析 (1)Mn原子核外電子數為25,處于第四周期ⅦB族,基態電子排布式為:1s22s22p63s23p63d54s2;
(2) 分子中苯環上的碳和醛基上的碳,都是sp2雜化,而亞甲基上的碳是sp3雜化;1mol
分子中苯環上的碳和醛基上的碳,都是sp2雜化,而亞甲基上的碳是sp3雜化;1mol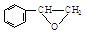 分子中含有8mol的碳氫單鍵、8mol的碳碳鍵和2mol的碳氧單鍵;
分子中含有8mol的碳氫單鍵、8mol的碳碳鍵和2mol的碳氧單鍵;
(3)等電子體是指具有相同原子數和相同價電子數的原子團;同一周期元素的第一電離能隨著原子序數的增大而呈增大的趨勢,但第IIA族和第VA族元素的第一電離能大于相鄰元素;
(4)N和Cl原子提供孤對電子,亞鐵離子提供空軌道,形成配位鍵,以此來解答;
解答 解:(1)Mn原子核外電子數為25,處于第四周期ⅦB族,基態電子排布式為:1s22s22p63s23p63d54s2,所以Mn3+基態的核外電子排布式為:1s22s22p63s23p63d4或[Ar]3d4,基態核外電子排布式為3d4,故答案為:3d4;
(2) 分子中苯環上的碳和醛基上的碳,都是sp2雜化,而亞甲基上的碳是sp3雜化,所以碳原子軌道的雜化類型是sp2、sp3,1mol
分子中苯環上的碳和醛基上的碳,都是sp2雜化,而亞甲基上的碳是sp3雜化,所以碳原子軌道的雜化類型是sp2、sp3,1mol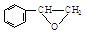 分子中含有8mol的碳氫單鍵、8mol的碳碳鍵和2mol的碳氧單鍵,所以1mol中含有18mol的σ鍵,故答案為:sp2、sp3;18mol;
分子中含有8mol的碳氫單鍵、8mol的碳碳鍵和2mol的碳氧單鍵,所以1mol中含有18mol的σ鍵,故答案為:sp2、sp3;18mol;
(3)CO32-,原子數為4,價電子數為:24,則NO3-、SiO32-、BF3(或BCl3、SO3) 為其等電子體,同一周期元素的第一電離能隨著原子序數的增大而呈增大的趨勢,但第IIA族和第VA族元素的第一電離能大于相鄰元素,所以C、N、O三種元素的第一電離能由大到小的順序為:N>O>C,故答案為:BF3(或BCl3、SO3); N>O>C;
(4)N和Cl原子提供孤對電子,亞鐵離子提供空軌道,形成配位體,所以配位原子是N、Cl,故答案為:N、Cl.
點評 本題考查配位鍵的形成,為高頻考點,把握配位鍵的形成及中心原子為解答本題的關鍵,側重分析與應用的考查,注意原子結構與性質的應用,題目難度不大.


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 51.2% | B. | 36% | C. | 22% | D. | 無法計算 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用NH4C1溶液溶解Mg(OH)2:Mg(OH)2+2NH4 +═Mg2十+2NH3•H2O | |
| B. | 用氨水除去NH4 C1溶液中的FeC13:Fe3++3OH-═Fe(OH)3 | |
| C. | Na2S水解:S2-+2H2O?H2S+2OH- | |
| D. | 用H2S氣體作為沉淀劑除去溶液中的Cu2+:Cu2++S2-═CuS↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某離子第三層上和第二層上的電子數均為第一層的 4 倍 | |
| B. | Cl-的結構示意圖: | |
| C. | 某物質的焰色反應為黃色,某物質一定為鈉的化合物 | |
| D. | 14C 和 14N 的質量數相等,互稱為同位素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 物質(括號內為雜質) | 試劑 | |
| A | CO2(SO2) | Na2CO3溶液 |
| B | FeCl3溶液(CuCl2) | Fe |
| C | Fe2O3(Al2O3) | NaOH溶液 |
| D | Na2SO4溶液(Na2CO3) | 鹽酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 8 mol/L | B. | 9 mol/L | C. | 11 mol/L | D. | 12 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1H、2H、3H互為同素異形體 | |
| B. | CO2的比例模型: | |
| C. | NaHCO3在水溶液中的電離方程式:NaHCO3?Na++HCO3-HCO3-?H++CO32- | |
| D. | 次氯酸的電子式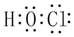 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CuCl2溶液蒸干灼燒后得到CuCl2固體 | |
| B. | 火力發電的目的是使化學能轉換為電能 | |
| C. | 已知C(石墨,s)=C(金剛石,s)△H>0,無法比較二者的穩定性. | |
| D. | 將FeCl3固體溶于適量蒸餾水來配制FeCl3溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com