
【題目】已知X、Y和Z三種元素的原子序數之和等于48。X的一種1∶1型氫化物分子中既有σ鍵又有π鍵。Z是金屬元素,Z的單質和化合物有廣泛的用途。已知Z的核電荷數小于28,且次外層有2個未成對電子。工業上利用ZO2和碳酸鋇在熔融狀態下制取化合物M(M可看做一種含氧酸鹽)。M有顯著的“壓電性能”,應用于超聲波的發生裝置。經X射線分析,M晶體的最小重復單元為正方體(如圖),邊長為4.03×10-10 m,頂點位置為Z4+所占,體心位置為Ba2+所占,所有棱心位置為O2-所占。

(1)Y在周期表中位于________________;
(2)與鋇同族的鎂鈣鍶的碳酸鹽受熱分解的溫度從上至下逐漸_______填“升高”或“降低”),原因是______________________________。
(3)①制備M的化學方程式是__________________________________。
②在M晶體中,若將Z4+置于正方體的體心,Ba2+置于正方體的頂點,則O2-處于正方體的________。
③在M晶體中,Z4+的氧配位數為________。
④已知O2-半徑為1.40×10-10 m,則Z4+半徑為____________________m。
【答案】 第四周期第ⅡA族 升高 它們的碳酸鹽的熱分解是由于晶體中的陽離子結合碳酸根離子中的氧離子,放出二氧化碳分子的結果,從鎂離子到鋇離子隨著半徑逐漸增大,結合氧離子的能力逐漸減弱,所以從上至下碳酸鹽受熱分解的溫度逐漸升高 TiO2+BaCO3(熔融)===BaTiO3+CO2↑ 面心 6 6.15×10-11
【解析】Z的核電荷數小于28,且次外層有2個未成對電子,其價層電子排布應當是![]() ,所以Z為Ti元素,X的一種
,所以Z為Ti元素,X的一種![]() 型氫化物分子中既有
型氫化物分子中既有![]() 鍵又有
鍵又有![]() 鍵,應為
鍵,應為![]() ,則X為C元素,X、Y和Z三種元素的原子序數之和等于48,則Y的原子序數為20,應為Ca元素;
,則X為C元素,X、Y和Z三種元素的原子序數之和等于48,則Y的原子序數為20,應為Ca元素;
(1)Y為Ca元素,原子序數為20,原子核外有4個電子層,最外層電子數為2,則應位于周期表第四周期、第ⅡA族;正確答案:第四周期、第ⅡA族。
(2)與鋇同族的鎂、鈣、鍶的碳酸鹽受熱分解的溫度從上至下逐漸升高,這是因為它們的碳酸鹽的熱分解是由于晶體中的陽離子結合碳酸根離子中的氧離子,放出二氧化碳分子的結果,從鎂離子到鋇離子隨著半徑逐漸增大,結合氧離子的能力逐漸減弱,所以從上至下碳酸鹽受熱分解的溫度逐漸升高;正確答案:升高; 它們的碳酸鹽的熱分解是由于晶體中的陽離子結合碳酸根離子中的氧離子,放出二氧化碳分子的結果,從鎂離子到鋇離子隨著半徑逐漸增大,結合氧離子的能力逐漸減弱,所以從上至下碳酸鹽受熱分解的溫度逐漸升高。
(3)①根據題意知M為![]() ,反應的化學方程式為TiO2+BaCO3(熔融)===BaTiO3+CO2↑;正確答案: TiO2+BaCO3(熔融)===BaTiO3+CO2↑。
,反應的化學方程式為TiO2+BaCO3(熔融)===BaTiO3+CO2↑;正確答案: TiO2+BaCO3(熔融)===BaTiO3+CO2↑。
②在![]() 晶體中,若將
晶體中,若將![]() 置于立方體的體心,
置于立方體的體心,![]() 置于立方體的頂點,則
置于立方體的頂點,則![]() 只能處于立方體的面心;正確答案:面心。
只能處于立方體的面心;正確答案:面心。
③由![]() 晶胞可以知道,每個
晶胞可以知道,每個![]() 周圍有6個
周圍有6個![]() ,所以
,所以![]() 的氧配位數為6;正確答案:6。
的氧配位數為6;正確答案:6。
④設![]() 的半徑為r,則有
的半徑為r,則有![]() ,則
,則![]() ;正確答案:
;正確答案:![]() 。
。


 探究與鞏固河南科學技術出版社系列答案
探究與鞏固河南科學技術出版社系列答案科目:高中化學 來源: 題型:
【題目】如圖表示1 g O2與1 g X氣體在恒壓條件下的密閉容器中體積(V)與溫度(T)的關系,則X氣體可能是
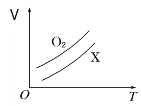
A. C2H4 B. CH4
C. CO2 D. NO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.某化學興趣小組在實驗室用如下裝置制備氯氣:

請回答:
(1)實驗裝置連接完成后,首先應進行的操作是_______________。
(2)寫出A裝置中制取氯氣的化學方程式____________________。
(3)若要制備純凈、干燥的氯氣,需在A、B之間添加凈化裝置D、E,其中導管連接的順序是____(填寫數字編號)。
Ⅱ.某化學實驗室產生的廢液中含有Fe3+、Cu2+、Ag+三種金屬離子,實驗室設計了方案對廢液進行以下三步處理,并回收金屬。

請回答:
(1)步驟①中得到的沉淀含有的金屬單質有__________。
(2)步驟②是將Fe2+轉化為Fe3+,還可以選用的試劑是_____(填字母)。
A.Fe粉 B.NaOH溶液 C.新制氯水 D.稀硫酸
(3)步驟③中加入氨水生成紅褐色沉淀的離子方程式為___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上乙醚可用于制造無煙火藥。實驗室合成乙醚的原理如下。
主反應 2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
副反應CH3CH2OH![]() H2C=CH2↑+H2O
H2C=CH2↑+H2O

【乙醚制備】裝置設計如下圖(部分裝置略)
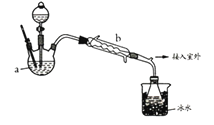
(1)儀器a是__________(寫名稱);儀器b應更換為下列的_______(填序號)。
A.干燥器 B.直形冷凝管 C.玻璃管 D.安全瓶
(2)實驗操作的正確排序為___________(填序號),取出乙醚立即密閉保存。
a.安裝實驗儀器 b.加入12mL濃硫酸和少量乙醇的混合物c.檢查裝置氣密性
d.熄滅酒精燈 e.通冷卻水并加熱燒瓶 f.拆除裝置 g.控制滴加乙醇速率與餾出液速率相等 (3)加熱后發現a中沒有添加碎瓷片,處理方法是___________________;反應溫度不超過145℃,其目的是___________________________。若滴入乙醇的速率顯著超過餾出液速率,反應速率會降低,可能原因是__________________________。
【乙醚提純】
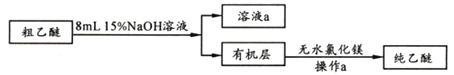
(4)粗乙醚中含有的主要雜質為_____________;無水氯化鎂的作用是_____________________。
(5)操作a的名稱是____;進行該操作時,必須用水浴代替酒精燈加熱,其目的與制備實驗中將尾接管支管通入室外相同,均為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學一物質結構與性質]
硒化鋅是一種半導體材料,回答下列問題。
(1)鋅在周期表中的位置_____________;Se基態原子價電子排布圖為___________。元素鋅、硫和硒第一電離能較大的是______________________(填元素符號)。
(2)Na2SeO3分子中Se原子的雜化類型為___________;H2SeO4的酸性比H2SeO3強,原因是_________________________________________________。
(3)氣態SeO3分子的立體構型為__________;下列與SeO3互為等電子體的有____(填序號)。
A.CO32- B.NO3- C.NCl3 D.SO32-
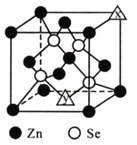
(4)硒化鋅的晶胞結構如圖所示,圖中X和Y點所堆積的原子均為_____(填元素符號);該晶胞中硒原子所處空隙類型為______________(填“立方體”、“正四面體”或正八面體”),該種空隙的填充率為____________;若該晶胞密度為pg·cm-3,硒化鋅的摩爾質量為Mg·mol-1。用NA代表阿伏加德羅常數的數值,則晶胞參數a為_____nm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組表述中,正確的是( )
A. 基態核外電子的排布為![]() 的原子3p能級有一個空軌道
的原子3p能級有一個空軌道
B. 第四周期中,未成對電子數最多的原子為Mn
C. Fe2+的基態核外電子排布為1s22s22p63s23p63d6
D. 2p能級有2個未成對電子的基態原子的價電子排布一定為2s22p2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某純堿樣品中含有氯化鈉雜質,用下圖裝置測定試樣中純堿的純度。主要實驗步驟如下:
①按圖組裝儀器并檢查裝置的氣密性
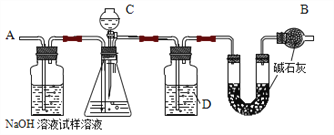
②將 a g 樣品放入錐形瓶,加適量水溶解。
③稱量裝有堿石灰的 U 形管的質量為 b g
④從C 滴下溶液到錐形瓶中無氣泡產生
⑤從A 處緩緩鼓入一定量空氣后,最終稱得U 形管的質量為 c g
(1)B 儀器的名稱是_____,其作用為_____。
(2)C 中裝的溶液是_____(填字母,下同)D 中裝的溶液是_____。
a.稀硫酸 b.濃硫酸 c.氫氧化鈉溶液 d.濃鹽酸
(3)步驟⑤的目的是_____。
(4)寫出純堿的純度的計算式_____(用字母表示)。
(5)若實驗中發現裝置 C 的活塞沒塞緊,存在漏氣情況,則所測得的結果會_____(填“偏大”、“偏小”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關敘述正確的是
①水的摩爾質量是18g
②0.5molH2的體積為11.2L
③1 mol 水中含有 2 mol 氫和 1mol 氧
④1mol 任何物質都約含有6.02×1023個分子
⑤0.5mol H2SO4含有的原子數目為3.5NA
⑥只有在標準狀況下,體積相同的任何氣體所含的分子數相同
⑦質量分數為40%的硫酸溶液與等體積的水混合,所得溶液濃度大于20%
⑧物質的量濃度為4mol/L 的硫酸溶液與等質量的水混合,所得溶液濃度小于2mol/L
A. ①③④⑤⑦⑧ B. ②⑤⑦⑧ C. ⑤⑦⑧ D. ⑤⑦
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com