
Ⅰ、已知將濃鹽酸滴入高錳酸鉀溶液中,產生黃綠色氣體,而溶液的紫紅色褪去。現有一個氧化還原反應的體系中共有KCl.Cl2.H2SO4.H2O.KMnO4.MnSO4.K2SO4七種物質:
(1)該反應中,化合價升高的反應物是 。
(2)寫出一個包含上述七種物質的氧化還原反應方程式:
(3)上述反應中,氧化劑是 ,1 mol氧化劑在反應中得到 mol電子。
Ⅱ、某研究性學習小組利用下列裝置制備漂白粉,并進行漂白粉有效成分的質量分數測定
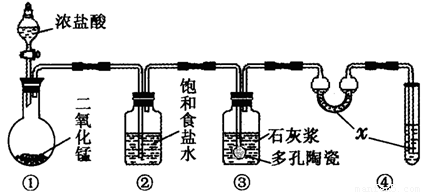
(1)裝置④中的x試劑為 。
(2)裝置③中發生反應的化學方程式為 。該反應是放熱反應,反應溫度較高時有副反應發生。改進該實驗裝置以減少副反應發生的方法是
_________________________。
(3)測定漂白粉有效成分的質量分數
稱取1.000 g漂白粉于錐形瓶中,加水溶解,調節溶液的pH,以淀粉為指示劑,用0.1000 mol·L-1 KI溶液進行滴定,溶液出現穩定淺藍色時為滴定終點。反應原理為:
3ClO-+ I- = 3Cl-+ IO3- IO3- + 5I- + 3H2O = 6OH- + 3I2
實驗測得數據如下表所示。
|
滴定次數 |
1 |
2 |
3 |
|
KI溶液體積/mL |
19.98 |
20.02 |
20.00 |
該漂白粉中有效成分的質量分數為 。若滴定過程中未充分振蕩溶液局部變淺藍色時就停止滴定,則測定結果將 (填“偏高”、“偏低”或“無影響”)
Ⅰ、(1)KCl(1分)
(2)2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2+8H2O(3分)
(3)KMnO4 (1分) 5mol (2分)
Ⅱ、(1)NaOH (1分) (2)2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O(3分)
將裝置③放于冷水浴中進行實驗(2分) (3)42.90% (2分) 偏低(2分)
【解析】
試題分析:Ⅰ、根據題意可知含七種物質的氧化還原反應為2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2+8H2O,化合價升高的物質為KCl;氧化劑為KMnO4 ; 1mol氧化劑得電子5mol ;
Ⅱ、因為氯氣有毒,所以x試劑為NaOH,吸收多余的氯氣;裝置③制取漂白粉,反應為2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;為避免溫度較高時發生副反應,可將裝置③放于冷水浴中進行實驗;(3)反應中消耗的KI的平均體積為20.00mL,其物質的量為0.1000mol/L×0.02L=0.002mol,
由題中“溶液出現穩定淺藍色時為滴定終點”,確定應用反應(1)解題:
由關系式3ClO-~I-
3 1
n 0.002
n=0.006mol,則n(Ca(ClO)2)=0.003mol,m=0.429g,
考點:氧化還原反應、化學實驗、滴定實驗。


 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:
 已知將濃鹽酸滴入高錳酸鉀溶液中,產生黃綠色氣體,而溶液的紫紅色褪去.現有一個氧化還原反應的體系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七種物質.
已知將濃鹽酸滴入高錳酸鉀溶液中,產生黃綠色氣體,而溶液的紫紅色褪去.現有一個氧化還原反應的體系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七種物質.查看答案和解析>>
科目:高中化學 來源: 題型:


查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:2010年廣西柳州二中高三第三次模擬考試(理科綜合)化學部分 題型:填空題
(16分)已知將濃鹽酸滴入高錳酸鉀溶液中,產生黃綠色氣體,而溶液的紫紅色褪去。現在一氧化還原反應的體系中,共有KCI、C12、H2SO4(濃)、H2O、KMnO4、Mn SO4、K2SO4七種物質:
SO4、K2SO4七種物質:
(1)該氧化還原反應的體系中,還原劑是 ,化合價沒有發生變化的反應物是 。
(2)寫出一個包含上述七種物質的氧化還原反應方程式(需配平):
。
(3)如果在反應后的溶液中加入NaBiO3溶液又變為紫紅色,BiO3-反應后變為無色的Bi3+該實驗證明NaBiO3具有 性。寫出該反應的離子反應方程式: 。
上述反應中,每生成1 mol Bi3+移的電子數為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com