
如圖所示為常見氣體制備、干燥、性質驗證和尾氣處理的部分儀器裝置(加熱及固定裝置均略去),儀器裝置可任意選擇,必要時可重復選用。
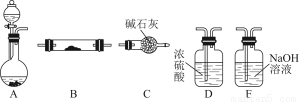
請回答下列問題:
(1)在裝置A的圓底燒瓶中裝入鋅片,分液漏斗中裝入稀硫酸,以驗證H2的還原性并檢驗其氧化產物。
①若按順序A→D→B→B→C連接時,則兩次使用的裝置B中所盛放藥品的化學式依次為CuO、 (填化學式)。
②檢驗裝置的氣密性后,在加熱裝有CuO的裝置B前必須進行的操作是 。
(2)在裝置A的錐形瓶中裝入Na2O2,分液漏斗中裝入濃氨水,裝置B中裝入固體催化劑,以進行氨的催化氧化。
①若裝置的連接順序為A→C→B→C,則裝置B中氨的催化氧化反應的化學方程式為 ,裝置B中可能觀察到的現象是 。
②若把裝置A制得的氣體與Cl2混合在一起,產生白煙,寫出反應的化學方程式 。該反應體現了氨的 性。
(1)①CuSO4 ②檢驗H2的純度
(2)①4NH3+5O2 4NO+6H2O 有紅棕色氣體生成
4NO+6H2O 有紅棕色氣體生成
②8NH3+3Cl2=N2+6NH4Cl 還原性
【解析】(1)①實驗目的為驗證H2的還原性并檢驗其氧化產物,可通過熾熱的CuO變紅驗證氫氣的還原性,通過無水硫酸銅變藍驗證H2的氧化產物水;②氫氣和空氣的混合氣體可能發生爆炸,所以氫氣在加熱前應驗純。(2)①NH3催化氧化產物為NO,常溫下即可與O2反應生成紅棕色的NO2;②由題意可知反應物為NH3和Cl2,有白煙產生說明生成了固態產物,應為NH4Cl,Cl2被還原,則還原劑應為NH3,在反應中被氧化為N2,根據元素守恒和電子守恒將方程式配平即可。


科目:高中化學 來源:2014高考化學二輪復習限時集訓 專題7化學反應速率和化學平衡練習卷A(解析版) 題型:選擇題
一定條件下,向某密閉容器中加入一定量的N2和H2發生可逆反應:N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1,測得0到10 s內,c(H2)減小了0.75 mol·L-1,下列說法正確的是( )
2NH3(g) ΔH=-92.2 kJ·mol-1,測得0到10 s內,c(H2)減小了0.75 mol·L-1,下列說法正確的是( )
A.10 s到15 s內c(NH3)增加量等于0.25 mol·L-1
B.10 s內氨氣的平均反應速率為0.025 mol·L-1·s-1
C.達平衡后,分離出少量NH3,v正增大
D.該反應的逆反應的活化能不小于92.2 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪復習限時集訓 專題4離子反應練習卷(解析版) 題型:選擇題
下列離子方程式或化學方程式與所述事實相符且正確的是( )
A.H218O中投入Na2O2固體:2H218O+2O22—=4OH-+18O2↑
B.向0.1 mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH- =H2O
C.以金屬銀為陽極電解飽和硫酸銅溶液:Cu2++2H2O=2Cu+O2↑+4H+
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42—完全沉淀:Al3++2SO42—+2Ba2++4OH-=AlO2—+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪復習限時集訓 專題16物質結構與性質練習卷(解析版) 題型:填空題
許多金屬及它們的化合物在科學研究和工業生產中具有許多用途。
回答下列有關問題:
(1)基態Ni的核外電子排布式為__________________________________________,
第二周期基態原子未成對電子數與Ni相同且電負性最小的元素是________。
(2)配合物Ni(CO)n的中心原子價電子數與配體提供電子總數之和為18,則n=________,CO與N2結構相似,CO分子內σ鍵與π鍵個數之比為________。
(3)NiO、FeO的晶體結構類型均與氯化鈉的相同。
①Ni2+和Fe2+的離子半徑分別為69 pm和78 pm,則熔點NiO________FeO(填“<”或“>”);
②NiO晶體中Ni的配位數為________。
(4)金屬Cu單獨與氨水或單獨與過氧化氫都不能反應,但可與氨水和過氧化氫的混合溶液反應,其原因是________________________________________________________________________________________________________________________________________________,
反應的離子方程式為________________________________________________________________________。
(5)一種銅金合金晶體具有面心立方最密堆積的結構。在晶胞中,Au原子位于頂點,Cu原子位于面心,則該合金中Au原子與Cu原子個數之比為________,若該晶胞的邊長為a pm,則合金的密度為________g·cm-3(只要求列算式,不必計算出數值,阿伏加德羅常數為NA)。
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪復習限時集訓 專題15化學與技術練習卷(解析版) 題型:填空題
銀氨溶液放久后會產生疊氮化銀(AgN3)而引起爆炸,直接排放會污染環境,且造成銀資源的浪費。某研究小組設計了從銀鏡反應后的廢液中(含過量的銀氨溶液,假設不含單質銀)回收銀的如下兩種實驗流程:
(已知:[Ag(NH3)2]+在溶液中存在平衡:[Ag(NH3)2]+??Ag++2NH3)
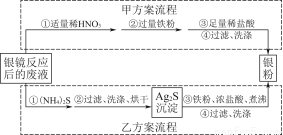
(1)寫出甲方案第①步廢液與稀HNO3反應的離子方程式 。
(2)甲方案第②步加入的鐵粉要過量的目的是 。
甲方案流程可能產生的大氣污染物是 。
(3)乙方案若最終得到銀粉的質量偏大,排除未洗滌干凈的因素,可能的原因是 。
(4)實驗室配制銀氨溶液的操作過程是 。
(5)已知乙方案第③步反應有H2S氣體產生,若最終得到銀粉21.6 g,不考慮其他損失,理論上該步需要加入鐵粉 g。
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪復習限時集訓 專題14綜合實驗與探究練習卷A(解析版) 題型:選擇題
用下列裝置能達到有關實驗目的的是( )
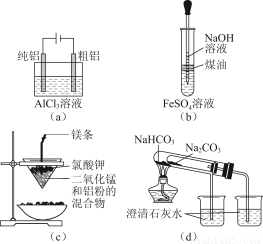
A.用圖(a)裝置電解精煉鋁
B.用圖(b)裝置制備Fe(OH)2
C.圖(c)裝置只可制得金屬鉀
D.圖(d)驗證NaHCO3和Na2CO3的熱穩定性
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪復習限時集訓 專題12有機物的結構與性質練習卷(解析版) 題型:填空題
某學習小組欲模擬從某工廠廢液中回收丙酮、乙醇和乙酸的實驗。制定了如下試驗流程。
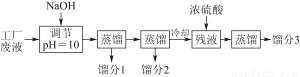
已知該廢液中主要含有乙醇,其中還溶有丙酮、乙酸和乙酸乙酯。且各種成分的沸點如下表:
物質 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
沸點(℃) | 56.2 | 77.06 | 78 | 117.9 |
(1)餾分3的成分為____________。
(2)上述流程中調節pH=10的目的是________________________________________________________________________________________________________________________________________________。
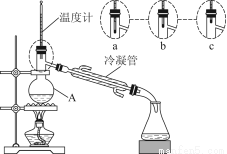
(3)該小組同學的蒸餾裝置如圖所示。則A中溫度計的位置正確的是________(填“a”“b”或“c”)。
(4)國家標準規定,優質高度濃香型白酒總酸量(以乙酸計)應不少于0.30 g/L,總酯量(以乙酸乙酯計)應不少于2.0 g/L。
①為測定某白酒樣品的總酸量,取20.00 mL樣品于錐形瓶中,加入酚酞指示劑2滴,用0.010 mol/L的NaOH標準溶液滴定至終點。判斷終點的依據是________________________________________________________________________________________________________________________________________________。
若該白酒樣品為優質級,則消耗NaOH溶液體積應不小于________mL。
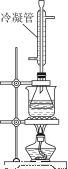
②白酒中的總酯量可用返滴法測定。往上題滴定后的溶液(恰好至終點)中再加入20.00mL0.100mol/L NaOH標準溶液,用圖裝置水浴加熱半小時。冷卻后用0.100mol/L的硫酸標準溶液滴定至終點。加熱半小時的目的是______________________,冷凝管的作用是______________。已知最終消耗硫酸標準溶液7.70 mL,該白酒樣品中總酯量為________g/L(保留小數點后三位數字)。
(5)下列操作會使總酯量測定結果偏高的是________(選填編號)
a.加熱時未使用水浴和冷凝管
b.滴定前滴定管內無氣泡,滴定后產生氣泡
c.滴定管未用硫酸標準溶液潤洗
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題四氧化還原反應練習卷(解析版) 題型:填空題
(1)將廢釩催化劑(主要成分V2O5)與稀硫酸、亞硫酸鉀溶液混合,充分反應,所得溶液顯酸性,含VO2+、K+、SO42-等。寫出該反應的化學方程式_________________________________。
(2)向上述所得溶液中加入KClO3溶液,充分反應后,溶液中新增加了VO2+、Cl-。寫出并配平該反應的離子方程式,并標出電子轉移的數目和方向______________________。
(3)在20.00 mL的0.1 mol·L-1 VO2+溶液中,加入0.195 g 鋅粉,恰好完成反應,則還原產物可能是______________________________________________________________。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和鹽酸反應生成氯氣和VO2+。請再寫一個離子反應方程式,說明還原性:SO32->Cl->VO2+__________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com