
| A. | 滴定管用水洗后,未用標準溶液潤洗就裝入標準溶液 | |
| B. | 用于取待測液的滴定管未用待測液潤洗 | |
| C. | 在搖動錐形瓶的過程中不慎濺出了一小部分溶液 | |
| D. | 標準液讀數時,滴定前仰視,滴定后俯視 |
分析 根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析不當操作對V(標準)的影響,不當操作導致V(標準)增大時,測定結果偏高,以此判斷濃度的誤差.
解答 解:A.滴定管用水洗后,未用標準溶液潤洗就裝入標準溶液,導致標準液濃度減小,所用V(標準)偏大,測定濃度偏高,故A選;
B.錐形瓶盛待測液前,未用待測液潤洗,是正確操作,故B不選;
C.在搖動錐形瓶的過程中不慎濺出了一小部分溶液,導致所用標準液體積偏小,測定濃度偏低,故C不選;
D.標準液讀數時,滴定前仰視,滴定后俯視,導致所讀標準液體積偏小,測定濃度偏低,故D不選;
故選A.
點評 本題主要考查了化學實驗操作中的誤差分析,題目難度不大,掌握實驗的原理及正確的誤差分析是解題的關鍵,試題培養了學生靈活應用所學知識的能力.


科目:高中化學 來源: 題型:實驗題
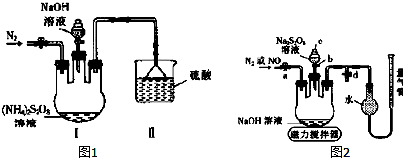
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=185.57 kJ•mol-1能自發進行,是因為體系有自發地向混亂度增大的方向轉變的傾向 | |
| B. | 能自發進行的反應一定能迅速發生 | |
| C. | 因為焓變和熵變都與反應的自發性有關,因此焓變或熵變均可以單獨做為判斷反應能否自發進行的判據 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,△S>0,不論在何種條件下都可能自發 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 平行實驗編號 | Na2C2O4溶液 (mL) | 滴定管起始讀數(mL) | 滴定管滴定終點讀數(mL) |
| 1 | 20.00 | 0.00 | 21.18 |
| 2 | 20.00 | 1.02 | 21.00 |
| 3 | 20.00 | 1.18 | 21.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 名稱 | 托盤天平 | 小燒杯 | 坩堝鉗 | 玻璃棒 | 藥匙 | 量筒 |
| 儀器 |  |  |  |  |  | |
| 序號 | a | b | c | d | e | f |
| 實驗 次數 | 起始溫度t1/℃ | 終止溫度 t2/℃ | 溫度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
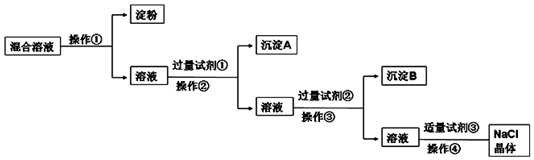
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
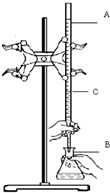 在實驗室用已知濃度的鹽酸滴定某未知濃度的NaOH溶液,裝置和操作如右圖所示.請回答:
在實驗室用已知濃度的鹽酸滴定某未知濃度的NaOH溶液,裝置和操作如右圖所示.請回答:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com