
【題目】下列離子方程式正確的是( )
A.在硫酸亞鐵溶液中加入稀硝酸:3Fe2++4H++NO3﹣═3Fe3++NO↑+2H2O
B.MnO2與濃鹽酸反應制取Cl2:MnO2+4HCl(濃)![]() Mn2++2Cl﹣+Cl2↑+2H2O
Mn2++2Cl﹣+Cl2↑+2H2O
C.過量的KHSO4與Ba(OH)2溶液反應:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O
D.向稀氫氧化鈉溶液中通入少量CO2:OH﹣+CO2═HCO3﹣
【答案】A
【解析】
試題分析:A.亞鐵離子被稀硝酸氧化成鐵離子,同時生成一氧化氮氣體;
B.濃鹽酸參加的反應中,濃鹽酸需要拆開,不能寫成分子形式;
C.硫酸氫鉀過量,離子方程式按照氫氧化鋇的組成書寫;
D.二氧化碳少量,反應生成碳酸鈉,不是 碳酸氫鈉.
解:A.硫酸亞鐵溶液中加入稀硝酸,亞鐵離子被氧化成鐵離子,反應的離子方程式為:3Fe2++4H++NO3﹣═3Fe3++NO↑+2H2O,故A正確;
B.MnO2與濃鹽酸反應制取Cl2,濃鹽酸應該拆開,正確的離子方程式為:MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O,故B錯誤;
Mn2++Cl2↑+2H2O,故B錯誤;
C.過量的KHSO4與Ba(OH)2溶液反應生成硫酸鋇和水,離子方程式按照氫氧化鋇的組成書寫,正確的離子方程式為:Ba2++2OH﹣+2H++SO42﹣═BaSO4↓+2H2O,故C錯誤;
D.稀氫氧化鈉溶液中通入少量CO2,反應生成碳酸氫鈉,正確的離子方程式為:2OH﹣+CO2═CO32﹣+H2O,故D錯誤;
故選A.


科目:高中化學 來源: 題型:
【題目】下面用序號給出了周期表中的部分元素,請從①~⑧中選擇合適的元素回答下列問題:
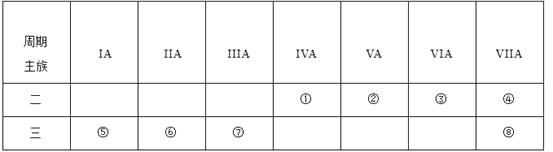
(1)上述元素中原子半徑最大的是(填元素符號) ,氣態氫化物最穩定的是(填化學式,下同) ,氣態氫化物水溶液呈堿性的是 ,最高價氧化物對應水化物酸性最強的是 .
(2)元素①與③按原子個數1:2構成的分子的電子式為 .
(3)元素⑤和⑦的最高價氧化物對應水化物反應的離子方程式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.漂白粉在溶液中存在平衡:ClO-+H2O![]() HClO+OH-,加少量NaOH能提高其漂白效率
HClO+OH-,加少量NaOH能提高其漂白效率
B、硫酸鋇難溶子水,但硫酸鋇屬于強電解質
C、滴定前滴定管內無氣泡,終點讀數時有氣泡,所測體積偏大
D、物質的量濃度相同的四種溶液:①氯化銨②硫酸氫銨 ③次氯酸銨④碳酸銨的pH:④>②>①>③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作正確的是( )
A.蒸餾時,將溫度計的水銀球插入液面下
B.稱量時,將硫酸銅晶體直接放在天平右盤上稱量
C.加熱時,將燒杯、試管直接放在酒精燈上加熱
D.聞氣味時,將少量的氣體用手輕輕扇入鼻孔中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z都是金屬,把X浸入Z的硝酸鹽溶液中,X的表面有Z析出,X和Y組成原電池時,Y為電池的負極.X、Y、Z三種金屬的活動性順序為( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學——選修5:有機化學基礎】環己烯常用于有機合成。現通過下列流程,以環己烯為原料合成環醚、聚酯、橡膠,其中F可以做內燃機的抗凍劑,J分子中無飽和碳原子。
已知:R1-CH=CH-R2![]() R1-CHO+R2-CHO
R1-CHO+R2-CHO
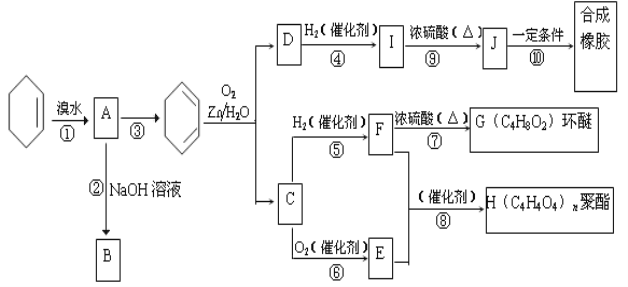
(1)B的名稱是___________,C中含有的官能團的名稱是______________。
(2)A的核磁共振氫譜圖上峰的個數為________,有機物B和I的關系為_________(填序號,多填扣分);
A.同系物 B.同分異構體 C.都屬于醇類 D.都屬于烴
(3)③的反應條件是___________________。
(4)寫出下列反應類型:④______________;⑨______________。
(5)寫出⑧反應化學方程式: 。
(6)試寫出C與新制銀氨溶液反應的化學方程式:_________________________。
(7)D的同分異構體中,可發生加成聚合反應,且能和NaHCO3反應,有__________種;其中結構中有三種氫原子,核磁共振氫譜面積比為1:2:3,試寫出結構簡式:_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量的SO2和O2充入一個容積固定的密閉容器中,在一定條件下發生反應:2SO2(g)+O2(g)![]() 2SO3(g),下列哪個量不再變化時,并不能說明化學反應已達到平衡狀態
2SO3(g),下列哪個量不再變化時,并不能說明化學反應已達到平衡狀態
A.混合氣體的密度
B.混合氣體的壓強
C.混合氣體的平均摩爾質量
D.SO2的轉化率
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com