
1 g H2完全燃燒生成液態水放出142.9 kJ熱量,表示該反應的熱化學方程式正確的是
A.2H2 + O2 == 2H2O ΔH=-571.6kJ?mol-1
B.H2(g)+![]() O2(g)== H2O( l ) ΔH=-142.9 kJ?mol-1
O2(g)== H2O( l ) ΔH=-142.9 kJ?mol-1
C.H2(g)+![]() O2(g)== H2O ( l ) ΔH=-285.8 kJ?mol-1
O2(g)== H2O ( l ) ΔH=-285.8 kJ?mol-1
D.2H2(g)+O2(g)== 2H2O ( g ) ΔH=-571.6 kJ?mol-1
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
由化學能產生的能量是目前人類使用的主要能源。請回答下列問題:
(1)N2和O2在一定條件下反應生成NO2的熱化學方程式為:
![]() N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。該反應為_____________(“放熱”“吸熱”)反應。
N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。該反應為_____________(“放熱”“吸熱”)反應。
(2)化學反應中的能量變化源自于化學反應中化學鍵變化時產生的能量變化。下表為一些化學鍵的鍵能:
| 化學鍵 | 鍵能( kJ·mol-1) | 化學鍵 | 鍵能( kJ·mol-1) |
| N≡N | 942 | H—O | 460 |
| N—H | 391 | O==O | 499 |
| H—H | 437 |
①寫出N2和H2反應合成氨的熱化學方程式_________________________。
② 已知:1 mol H2O(g)轉化為1 mol H2O(l)時放出44.0 kJ的熱量。計算1 g H2完全燃燒時放出的熱量___________________。H2O(g)的穩定性___________(“大于”“小于”)H2O(l)。
(3)寫出NH3(g)在O2(g)中完全燃燒生成NO2(g)和H2O(g)的熱化學方程式_________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年山東省煙臺市高三上學期期末統考化學試卷(解析版) 題型:填空題
能源的開發、利用與人類社會的可持續發展息息相關,充分利用好能源是擺在人類面前的重大課題。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
則反應4Fe(s)+3O2(g)=2Fe2O3(s)的焓變ΔH= kJ·mol-1。
Ⅱ.依據原電池的構成原理,下列化學反應在理論上可以設計成原電池的是 (填序號)。
A.C(s)+CO2(g)=2CO(g) ΔH>0 B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸為電解質溶液,則該原電池的正極反應式為 。
Ⅲ.氫氣作為一種綠色能源,對于人類的生存與發展具有十分重要的意義。
(1)實驗測得,在通常情況下,1 g H2完全燃燒生成液態水,放出142.9 kJ熱量。則H2燃燒的熱化學方程式為 。
(2)用氫氣合成氨的熱化學方程式為N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
①一定條件下,下列敘述可以說明該反應已達平衡狀態的是 。
A.υ正(N2)=υ逆(NH3)
B.各物質的物質的量相等
C.混合氣體的物質的量不再變化
D.混合氣體的密度不再變化
②下圖表示合成氨反應達到平衡后,每次只改變溫度、壓強、催化劑中的某一條件,反應速率υ與時間t的關系。其中表示平衡混合物中的NH3的含量最高的一段時間是 。圖中t3時改變的條件可能是 。

③溫度為T℃時,將4a mol H2和2a mol N2放入0.5 L密閉容器中,充分反應后測得N2的轉化率為50%,則反應的平衡常數為 。
查看答案和解析>>
科目:高中化學 來源:2012屆江西省撫州市教研室高二上學期期末考試化學試卷 題型:填空題
(12分)氫氣是一種新型的綠色能源,又是一種重要的化工原料。
(1)氫氣燃燒熱值高,實驗測得,在常溫常壓下, 1 g H2完全燃燒生成液態水,放出
142.9 kJ熱量,則H2燃燒的熱化學方程式為__________________________________。
(2)氫氧燃料電池能量轉化率高,具有廣闊的發展前景。現將氫氧燃料電池進行下圖所示實驗:①氫氧燃料電池中,負極的電極反應式為__________________, ②如圖實驗裝置中,某一銅電極的質量減輕3.2 g,則 a極上消耗的O2在標準狀況下的體積____________L。
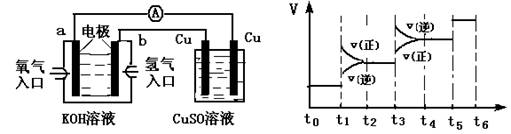
(3)氫氣是合成氨的重要原料,合成氨反應的熱化學方程式如下:
N2(g)+3H2(g)  2NH3(g);ΔH=-92.4 kJ/mol,
2NH3(g);ΔH=-92.4 kJ/mol,
①當合成氨反應達到平衡后,改變某一外界條件(不改變N2、H2和NH3的量),反應速率與時間的關系如圖所示: 圖中t1時引起平衡移動的條件可能是_________________,其中表示平衡混合物中NH3的含量最高的一段時間是____________。
②溫度為T ℃時,將2 a mol H2和a mol N2放入0.5 L密閉容器中,充分反應后測得N2的轉化率為50% ,則反應的平衡常數為____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com