
【題目】把活潑金屬片a和b放在盛有稀食鹽水和酚酞混合液的表面皿中,構成如圖所示原電池,一段時間后觀察到區域I變紅色,則下列敘述正確的是( )
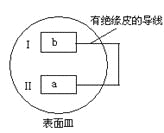
A.a是原電池的負極B.b的活潑性大于a
C.無電流產生D.b 電極上有氣泡產生
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列裝置圖的使用說法正確的是( )
A.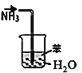 裝置吸收NH3制氨水
裝置吸收NH3制氨水
B. 裝置不需添加其它儀器就能檢驗其氣密性
裝置不需添加其它儀器就能檢驗其氣密性
C.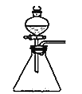 裝置中,向石灰石中滴加硫酸溶液,制取二氧化碳
裝置中,向石灰石中滴加硫酸溶液,制取二氧化碳
D.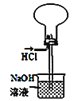 裝置收集并吸收多余的HCl
裝置收集并吸收多余的HCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學研究小組探究外界條件對化學反應mA(g)+nB(g) pC(g)的速率和平衡的影響圖象如下,下列判斷正確的是

A.由圖1可知,![]() ,該反應正反應為吸熱反應
,該反應正反應為吸熱反應
B.由圖2可知,該反應![]()
C.圖3中,點3的反應速率:v正>v逆
D.圖4中,若![]() ,則a曲線一定使用了催化劑
,則a曲線一定使用了催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從明礬[KAl(SO4)2·12H2O]制備Al、K2SO4和H2SO4的流程如下:
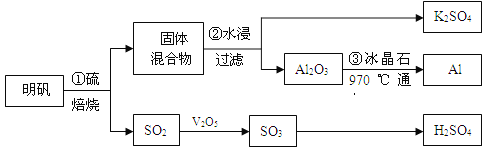
已知:明礬焙燒的化學方程式為:4[KAl(SO4)2·12H2O] + 3S=2K2SO4+ 2Al2O3 + 9SO2↑+ 48H2O
請回答下列問題:
(1)在焙燒明礬的反應中,氧化產物與還原產物的物質的量之比為: 。
(2)步驟②中,為提高浸出率,可采取的措施有_____________。
A.粉碎固體混合物 | B.降低溫度 | C.不斷攪拌 | D.縮短浸泡時間 |
(3)明礬焙燒完全后,從步驟②的濾液中得到K2SO4晶體的方法是 。
(4)步驟③電解的化學方程式是 ,電解池的電極是用碳素材料做成,電解過程中,陽極材料需要定期更換,原因是: 。
(5)以Al和NiO(OH)為電極,NaOH溶液為電解液組成一種新型電池,放電時NiO(OH)
轉化為Ni(OH)2,則該電池的正極電極反應式是 。
(6)焙燒a噸明礬(摩爾質量為b g/mol),若SO2的轉化率為96%,可生產質量分數為98%的H2SO4質量為 噸(列出計算表達式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Mn3O4是一種高性能結構材料,可由含鈣鎂離子的硫酸錳浸出液為原料制備。其工藝流程如圖所示:
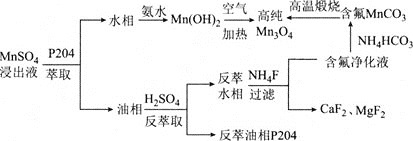
請回答下列問題:
⑴四氧化三錳(Mn3O4)中錳元素的化合價有+2價和+3價,其化學式可改寫為________(選項字母)。
A. MnO Mn2O3 B. 2MnO MnO2 C. Mn2O Mn2O3 D. MnO MnO2
⑵是P2O4密度小于水的無色液體,用P2O4萃取碘水中的碘,振蕩、靜置后的現象為________。
⑶寫出由Mn(OH)2制備Mn3O4的化學方程式:________。
⑷通常認為殘留在溶液中的離子濃度小于1×10-5 mol·L-1時,沉淀完全。若要除去Ca2+、Mg2+,則殘留液中c(F-)應不小于_______ mol·L-1,![]() =________[已知:Ksp(CaF2) = 2.7×10-11,Ksp(MgF2) =6.5×10-9,
=________[已知:Ksp(CaF2) = 2.7×10-11,Ksp(MgF2) =6.5×10-9,![]() ,
,![]() ;保留三位有效數字]。
;保留三位有效數字]。
⑸可由“水相”制備高純度單質錳,裝置如圖所示:
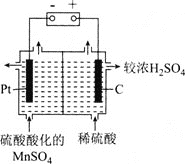
①裝置中采用________![]() 填“陰離子”或“陽離子”
填“陰離子”或“陽離子”![]() 交換膜。
交換膜。
②寫出該電解反應的化學方程式:________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在0.1mol·L-1CH3COOH溶液中存在如下電離平衡:CH3COOH![]() CH3COO-+H+對于該平衡,下列敘述正確的是( )
CH3COO-+H+對于該平衡,下列敘述正確的是( )
A.加入水時,平衡向逆方向移動
B.加入少量NaOH固體,平衡向正方向移動
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)不變
D.加入少量CH3COONa固體,平衡向正方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[雙選題]鋁-空氣原電池通常以![]() 溶液或
溶液或![]() 溶液為電解質溶液,鋁合金為負極,空氣電極為正極。下列說法不正確的是( )
溶液為電解質溶液,鋁合金為負極,空氣電極為正極。下列說法不正確的是( )
A.以![]() 溶液或
溶液或![]() 溶液為電解質溶液時,正極的電極反應均為
溶液為電解質溶液時,正極的電極反應均為![]()
B.以溶液為電解質溶液時,負極的電極反應為![]()
C.以![]() 溶液為電解質溶液時,負極的電極反應為
溶液為電解質溶液時,負極的電極反應為![]()
D.以![]() 溶液為電解質溶液時,負極的電極反應
溶液為電解質溶液時,負極的電極反應![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】錳酸鋰離子蓄電池是第二代鋰離子動力電池。一種以軟錳礦漿![]() 主要成分為MnO2,含少量Al2O3、Fe2O3、Fe2O、SiO2等雜質
主要成分為MnO2,含少量Al2O3、Fe2O3、Fe2O、SiO2等雜質![]() 為原料制備錳酸鋰的流程如下圖所示。
為原料制備錳酸鋰的流程如下圖所示。
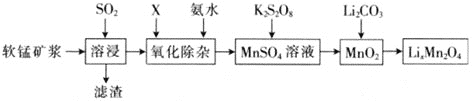
⑴溶浸過程中,為提高SO2吸收率,可采取的措施有________![]() 填字母
填字母![]() 。
。
a.不斷攪拌,使SO2和軟錳礦漿充分接觸 b. 增大通入SO2的速率
c. 減小軟錳礦漿的進入量 d. 減小通入SO2的速率
⑵已知:室溫下,Ksp[Al(OH)3] =1×10-33,Ksp[Fe(OH)3] =1×10-39,pH =7.1時Mn(OH)2開始沉淀。氧化除雜(室溫)是除去MnSO4溶液中的Fe3+、Al3+(使其濃度小于1×10-6 mol·L-1),則需調節溶液pH的范圍為________。
⑶硫酸錳與K2S2O8溶液在常溫下混合一周,可慢慢得到球形二氧化錳(MnO2)。請寫出發生反應的離子方程式:________。
⑷將MnO2和Li2CO3按物質的量4:1進行配料,充分攪拌,混合均勻然后升溫至600~700℃,制取產品LiMn2O4。寫出該反應的化學方程式:________。該反應中氧化劑為_______(填化學式)。
⑸錳酸鋰可充電電池的總反應為Li1-xMn2O4 + LixC![]() LiMn2O4 + C(0 < x < 1)。
LiMn2O4 + C(0 < x < 1)。

①充電時,電池的陽極反應式為________。
②廢舊錳酸鋰電池中可能殘留單質鋰,拆解不當易著火、爆炸,為了安全,拆解的注意事項是________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com