
 苯甲酸是一種重要的化工產品,某學習小組設計方案制備苯甲酸.反應原理如下:
苯甲酸是一種重要的化工產品,某學習小組設計方案制備苯甲酸.反應原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2+H2O
+KOH+2MnO2+H2O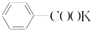 +HCl→
+HCl→ +KCl
+KCl
分析 (1)支管連接了恒壓滴液漏斗中的液體上、下方,使恒壓滴液漏斗中的液體上、下方的壓強相等;
(2)本實驗中用到的液體體積約為55mL,據此選擇三頸燒瓶的規格;
反應混合物過濾得到濾液通過分液得到有機相和水相,有機相中用無水硫酸鈉干燥,蒸餾過濾得到無色液體A,水相加入濃鹽酸酸化,蒸發濃縮冷卻結晶過濾洗滌得到白色固體B,
(3)依據流程分析混合物分離的實驗方法和操作步驟;
(4)結合反應化學方程式中生成的產物和流程中分離步驟分析,發現其在115℃開始熔化,達到130℃時仍有少量不熔,推測白色固體B是苯甲酸與KCl的混合物,先檢驗苯甲酸的檢驗再檢驗氯化鉀的存在,利用硝酸酸化的硝酸銀檢驗氯離子的存在.
解答 解:(1)支管連接了恒壓滴液漏斗中的液體上、下方,使恒壓滴液漏斗中的液體上、下方的壓強相等,便于甲苯順利滴入三頸燒瓶,
故答案為:平衡壓強,便于甲苯順利滴入三頸燒瓶;
(2)本實驗中用到的液體體積約為55mL,所以選擇100mL的三頸燒瓶,故選B,
故答案為:B;
(3)一定量的甲苯和KMnO4溶液在100℃反應一段時間后停止反應,按流程分離出苯甲酸和回收未反應的甲苯;所以操作Ⅰ是分離出有機相甲苯,用分液方法得到;操作Ⅱ是蒸餾的方法控制甲苯沸點得到純凈的甲苯液體,
故答案為:分液;蒸餾;
(4)操作Ⅲ的名稱是冷卻結晶、過濾得到白色固體B,通過測定白色固體B的熔點,發現其在115℃開始熔化,達到130℃時仍有少量不熔,推測白色固體B是苯甲酸與KCl的混合物,氯化鉀可以用硝酸酸化的硝酸銀溶液檢驗氯離子的存在,滴入適量的硝酸酸化的AgNO3溶液,若產生白色沉淀,則B中含有Cl-.
故答案為:冷卻結晶、過濾;AgNO3.
點評 本題考查了物質性質的實驗原理的分析判斷,物質分離條件,試劑選擇,操作步驟的理解應用,物質成分的實驗設計方案、步驟、試劑,樣品純度的計算,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | CH3CH2COOCH(CH3)2 | B. | CH3CH2COOCH2CH=CH2 | ||
| C. | (CH3)2CHCOOCH2CH(CH3)2 | D. | CH3CH2CH2COOCH2CH(CH3)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(SO2)(mol•L-1) | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 | 3.00×10-37 |
| c(CO)(mol•L-1) | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 | 2.00 |
| 實驗 編號 | T(℃) | SO2初始濃度 (mol•L-1) | CO初始濃度 (mol•L-1) | 催化劑 |
| Ⅰ | 260 | 1.00 | 3.00 | Cr2O3 |
| Ⅱ | Fe2O3 | |||
| Ⅲ | 380 | |||
| Ⅳ | 4.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 80mL 10mol•L-1 鹽酸與足量MnO2加熱反應,產生Cl2分子數為0.2NA | |
| B. | 2 L0.5 mol•L-1硫酸鉀溶液中陰離子所帶電荷數為NA | |
| C. | 標況下,11.2 L氯氣完全溶于1 L水中,所得溶液中Cl-和ClO-兩種粒子數之和為NA | |
| D. | 標準狀況下,11.2LSO3所含的分子數大于0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com