
 CO2(g)+H2(g)。t℃時,往10L密閉容器中充入2mol CO和3mol水蒸氣。反應建立平衡后,體系中c(H2)=0.12mol·L-1。則該溫度下此反應的平衡常數K= (填計算結果)。
CO2(g)+H2(g)。t℃時,往10L密閉容器中充入2mol CO和3mol水蒸氣。反應建立平衡后,體系中c(H2)=0.12mol·L-1。則該溫度下此反應的平衡常數K= (填計算結果)。 2NH3(g) △H<0。下表為不同溫度下該反應的平衡常數。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表為不同溫度下該反應的平衡常數。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
 CO2(g)+H2(g)
CO2(g)+H2(g)

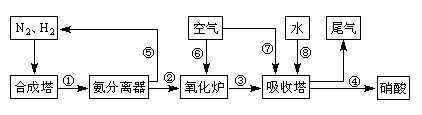
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:不詳 題型:問答題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.-67.7 kJ /mol | B.-43.5kJ /mol |
| C.+43.5 kJ/ mol | D.+67.7 kJ/ mol |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+45.2 kJ·mol-1 | D.+69.4 kJ·mol-1 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題


 CO(g)+2H2(g),H2的物質的量隨時間變化的曲線如圖所示。
CO(g)+2H2(g),H2的物質的量隨時間變化的曲線如圖所示。
 CH3OH(g)的平衡常數K=__________。相同溫度下,若開始時加入CH3OH(g)的物質的量是原來的2倍,則__________(填序號)是原來的2倍。
CH3OH(g)的平衡常數K=__________。相同溫度下,若開始時加入CH3OH(g)的物質的量是原來的2倍,則__________(填序號)是原來的2倍。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 2NH3(g)ΔH=-92.2kJ·mol-1
2NH3(g)ΔH=-92.2kJ·mol-1
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
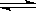 2NH3(g) △H=-92.4kJ/mol
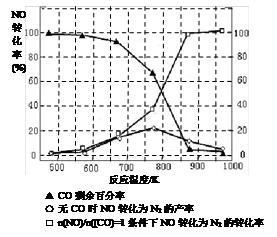
2NH3(g) △H=-92.4kJ/mol 2NH3(g)反應的影響。
2NH3(g)反應的影響。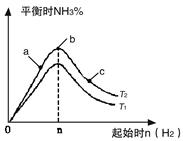
 4NO2(g)+O2(g) ΔH>0下表為反應在T1溫度下的部分實驗數據
4NO2(g)+O2(g) ΔH>0下表為反應在T1溫度下的部分實驗數據| t/s | 0 | 50 | 100 |
| c(N2O5)/mol·L—1 | 5.0 | 3.5 | 2.4 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 CO2(g)+2H2O(l) ΔH1=-Q1
CO2(g)+2H2O(l) ΔH1=-Q1 H2O(g) ΔH2=-Q2
H2O(g) ΔH2=-Q2 H2O(l) ΔH3=-Q3,常溫下取體積比為4∶1的甲烷和氫氣的混合氣體11.2 L(已折合成標準狀況),經完全燃燒恢復到常溫,放出的熱量是( )
H2O(l) ΔH3=-Q3,常溫下取體積比為4∶1的甲烷和氫氣的混合氣體11.2 L(已折合成標準狀況),經完全燃燒恢復到常溫,放出的熱量是( )| A.0.4Q1+0.05Q2 | B.0.4Q1+0.1Q2 |
| C.0.4Q1+0.05Q3 | D.0.4Q1+0.1Q3 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1 CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1 C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1 CH3OCH3(g) + 3H2O(g)。已知一定條件下,該反應中CO2的平衡轉化率隨溫度、投料比[n(H2) / n(CO2)]的變化曲線如下左圖:
CH3OCH3(g) + 3H2O(g)。已知一定條件下,該反應中CO2的平衡轉化率隨溫度、投料比[n(H2) / n(CO2)]的變化曲線如下左圖:


查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com