
【題目】氧化還原是一類重要的反應。
(1)已知反應2I-+2Fe3+=I2+2Fe2+,反應中還原劑是_________,氧化性Fe3+______I2 (填“ < ”或“ > ”) 。
(2)在2Na2O2+2CO2=2Na2CO3+O2反應中,若轉移3mol電子,則所產生的氧氣在標準狀況下的體積為___________L。
(3)在xR2++yH++O2═mR3++nH2O的離子方程式中,對系數m和R2+、R3+判斷正確的是__。
A.m=y,R3+是還原劑 B.m=2y,R2+被氧化
C.m=2,R3+是氧化劑 D.m=4,R2+是還原劑
(4)用雙線橋標出反應2KMnO4+16HCl(濃)═2KCl+2MnCl2+5Cl2↑+8H2O中電子轉移的方向和數目_________。
(5)氯氣和石英砂、碳粉共熱可發生反應:SiO2+2C+2Cl2![]() SiCl4+2CO當反應消耗6g碳時,生成還原產物_________mol。
SiCl4+2CO當反應消耗6g碳時,生成還原產物_________mol。
【答案】 I- > 33.6 D  0.25
0.25
【解析】(1)碘離子氧化為碘單質,反應中做還原劑;Fe3+價態降低,發生還原反應,做氧化劑,碘單質為氧化產物,因此氧化性:Fe3+>I2;正確答案:I- ; >。
(2)在2Na2O2+2CO2=2Na2CO3+O2反應中,轉移電子的量為2mol,生成氧氣1 mol;若轉移3mol電子,則所產生的氧氣在標準狀況下的體積為1.5×22.4= 33.6 L;
(3)在xR2++yH++O2═mR3++nH2O的離子方程式中,R2+→R3+,發生氧化反應,O2→H2O,發生還原反應,因此R2+是還原劑,被氧化,根據原子守恒規律可知:x=m, y=2n, 又知n=2,所以y=4,根據電荷守恒規律可知:2m+ y=3m,m=y=4,因此m=4,R2+是還原劑正確,正確答案:D。
(4)KMnO4中Mn元素為+7價降低到MnCl2中的+2價,2molKMnO4轉移電子的量為2×5=10 mol;16molHCl(濃)中有10molHCl被氧化5mol Cl2,轉移電子用雙線橋標出電子轉移的方向和數目如下: ;正確答案:
;正確答案: 。
。
(5)該反應中碳做還原劑,被氧化,對應氧化物產物為CO;氯氣做氧化劑,被還原,對應還原產物為SiCl4,根據反應關系:2C--- SiCl4可知當反應消耗6g碳時(即0.5 mol)時, 生成SiCl4的量為0.25 mol,正確答案:0.25。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】已知短周期元素的四種離子A2+、B+、C3-、D-具有相同的電子層結構,則下列敘述中正確的是
A. 原子序數:D>C>B>A B. 原子半徑:B>A>C>D
C. 離子半徑:C3->D->A2+>B+ D. 氧化性:A2+>B+,還原性:C3-<D-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.氧化還原反應的實質是電子的轉移
B.置換反應不一定是氧化還原反應
C.氧化劑發生氧化反應
D.有單質參加或者生成的反應一定屬于氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某混合物甲中含有明礬[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定條件下由甲可實現下圖所示的物質之間的轉化:
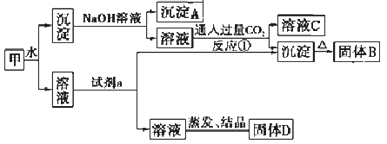
請回答下列問題:
(1)寫出A、B的化學式:A________ B_________。
(2)試劑a最好選用下列試劑中的_________。
A.NaOH溶液 B.稀鹽酸 C.二氧化碳 D.氨水
請寫出相應的離子方程式___________。
(3)寫出反應①(生成溶液C和沉淀)的離子方程式_________。
(4)固體D可以作為復合性的化學肥料,D中所含物質的化學式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各表述與示意圖一致的是( ) 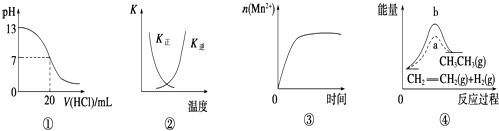
A.圖①表示25℃時,用0.1 mol/L鹽酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH隨加入酸體積的變化
B.圖②中曲線表示反應2SO2(g)+O2(g)2SO3(g)△H<0正、逆反應的平衡常數K隨溫度的變化
C.圖③表示10 mL 0.01 mol/L KMnO4酸性溶液與過量的0.1 mol/L H2C2O4溶液混合時,n(Mn2+)隨時間的變化
D.圖④中a、b曲線分別表示反應:CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化劑時,反應過程中的總能量變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】右圖是某學校實驗室從化學試劑商店買回的硫酸試劑標簽上的部分內容。據此下列說法錯誤的是( )
硫酸化學純(CP)
(500mL)
品名:硫酸
化學式:H2SO4
相對分子質量:98
密度:1.84g/cm3
質量分數:98%
A. 該硫酸試劑的物質的量濃度為18.4mol·L-1
B. 該硫酸與等體積的水混合所得溶液的質量分數大于49%
C. 配制200.0mL4.6mol·L-1的稀硫酸需取該硫酸50.0mL
D. 常溫下,將2.7gAl投入足量該硫酸中可得到標準狀況下的氫氣3.36L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】六種短周期元素a、b、c、d、e、f其原子序數與其最高正價或最低負價的關系如下圖所示。

(1)上述六種元素,其中屬于金屬元素的有________種。
(2)元素f在周期表中的位置是____________。
(3)由a、b、c三種元素組成既含離子鍵又含共價鍵的化合物,該化合物的化學式為________,該化合物的水溶液顯_________性,該化合物在水中的電離方程式為____________。
(4)b元素的氣態氫化物與f元素的氣態氫化物熔沸點高低順序為_________(用氫化物的化學式表示)。
(5)a與b、c兩元素分別可形成18電子的分子M和N,其中M的電子式為_______。化合物M是一種環保的液體燃料,常溫下8g液態M與足量的液態N反應可放出204.5kJ的熱量,則該反應的熱化學反應方程式為___________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com