
 汽車安全氣囊一般由傳感器、氣囊、氣體發生器等組成.
汽車安全氣囊一般由傳感器、氣囊、氣體發生器等組成.分析 (1)①非金屬性越強第一電離能越大,N元素原子2p能級為半滿穩定狀態,第一電離能高于同周期相鄰元素的;
②NO2-中中N原子孤電子對數=$\frac{5+1-2×2}{2}$=1、價層電子對數=2+1=3;
③N2H4中N原子形成3個σ鍵、含有1對孤對電子,雜化軌道數目為4;N2H4與水分子都是極性分子,相似相溶原理,N2H4與水分子之間形成氫鍵;
(2)①Ni元素原子核外電子數為28,根據能量最低原理書寫核外電子排布式;
②Al碳原子原子之間形成單鍵、C原子與氫原子之間形成單鍵,均為σ鍵;
③根據均攤法計算晶胞中Co、O原子數目,進而確定化學式.
解答 解:(1)①非金屬性越強第一電離能越大,N元素原子2p能級為半滿穩定狀態,第一電離能高于同周期相鄰元素的,故第一電離能:N>O>H>Na,
故答案為:N;
②NO2-中N原子孤電子對數=$\frac{5+1-2×2}{2}$=1、價層電子對數=2+1=3,NO2-空間構型是V形,
故答案為:V;
③N2H4中N原子形成3個σ鍵、含有1對孤對電子,雜化軌道數目為4,N原子采取sp3雜化;N2H4與水分子都是極性分子,相似相溶原理,N2H4與水分子之間形成氫鍵,N2H4極易溶于水,
故答案為:sp3;N2H4與水分子都是極性分子,相似相溶原理,N2H4與水分子之間形成氫鍵;
(2)①Ni元素原子核外電子數為28,根據能量最低原理,核外電子排布式為1s22s22p63s23p63d84s2,
故答案為:1s22s22p63s23p63d84s2;
②Al碳原子原子之間形成單鍵、C原子與氫原子之間形成單鍵,均為σ鍵,分子中含有的σ鍵的數目為12,
故答案為:12;
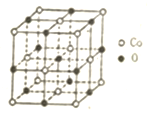
③晶胞中Co原子數目為6×$\frac{1}{2}$+8×$\frac{1}{8}$=4、O原子數目=1+12×$\frac{1}{4}$=4,故該化合物的化學式為CoO,
故答案為:CoO.
點評 本題是對物質結構與性質的考查,涉及電離能、雜化方式與空間構型判斷、分子結構與性質、化學鍵、核外電子排布、晶胞計算等,注意同周期元素第一電離能異常情況,難度中等.


 活力試卷系列答案
活力試卷系列答案 課課優能力培優100分系列答案
課課優能力培優100分系列答案科目:高中化學 來源: 題型:多選題
| A. | 濃硫酸沾到皮膚上時,可立刻用大量的水沖洗,然后再涂上3%~5%的NaHCO3溶液 | |
| B. | 取用化學藥品時,應特別注意觀察藥品包裝容器上的安全警示標志 | |
| C. | 凡是給玻璃儀器加熱,都要加墊石棉網,以防儀器炸裂 | |
| D. | 聞任何化學藥品的氣味都不能將鼻子湊近藥品 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | FeS04•7H20-綠礬 | B. | Na2O2-火堿 | C. | BaC03-重晶石 | D. | C6Hl206-庶糖 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
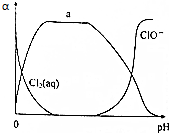 氯及其化合物在自來水消毒和果蔬保鮮等方面應用廣泛.
氯及其化合物在自來水消毒和果蔬保鮮等方面應用廣泛.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鐵與過量的稀鹽酸反應:2Fe+6H+→2Fe3++3H2↑ | |
| B. | 氯化亞鐵溶液中通入少量氯氣:Fe2++Cl2→Fe3++2Cl- | |
| C. | 氧化鋁與氫氧化鈉溶液反應:Al2O3+2OH-=2AlO2-+H2O | |
| D. | 氯化鋁溶液中加入過量的氨水:Al3++3OH-→Al(OH)3↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常作為氣體的干燥劑 | B. | 常溫下不能與鐵發生反應 | ||
| C. | 滴在蔗糖上,蔗糖會變黑 | D. | 工業上主要采用接觸法制備 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若C(石墨,s)═C(金剛石,s)△H>0,則金剛石比石墨穩定 | |
| B. | 等質量的硫蒸氣和硫磺固體分別完全燃燒,后者放出的熱量多 | |
| C. | 相同體積濃度均為0.1 mol/L 鹽酸和醋酸溶液分別與足量的NaOH稀溶液反應,前者放出熱量多 | |
| D. | 氫氣的燃燒熱為285.8 kJ/mol,則氫氣燃燒的熱化學方程式為:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com