
| A. | 至少存在5種離子 | |
| B. | Cl-一定存在,且c(Cl-)≥0.2mol/L | |
| C. | SO42-、NH4+、Fe3+一定存在,Al3+、K+、Cl-可能存在 | |
| D. | CO32-一定不存在,SO42-、NH4+、Fe3+、Cl-一定存在 |
分析 某溶液可能含有Cl-、SO42-、CO32-、HCO3-、NH4+、Fe3+、Ba2+和K+,取該溶液100mL,加入過量NaOH溶液加熱,得到0.02mol氣體,判斷為氨氣,NH4++OH-=NH3↑+H2O,溶液中一定含NH4+,物質的量為0.02mol,同時產生1.97g白色沉淀,分析可知溶液中一定含Ba2+,則一定不含SO42-、CO32-、Fe3+,白色沉淀為BaCO3,是碳酸氫根離子和氫氧化鈉反應生成碳酸根離子結合鋇離子生成的碳酸鋇白色沉淀,向上述濾液中加足量BaCl2溶液,也得到1.97g沉淀是碳酸鋇沉淀,則碳酸氫根離子物質的量=$\frac{1.97g}{197g/mol}$+$\frac{1.97g}{197g/mol}$=0.02mol,原溶液中Ba2+物質的量=$\frac{1.97g}{197g/mol}$=0.01mol,結合溶液中電荷守恒分析判斷其他離子是否存在,陽離子:n(NH4+)+2n(Ba2+)=0.02mol+2×0.02mol=0.06mol,n(HCO3-)=0.02mol,則一定含Cl-物質的量最少為0.02mol,K+可能含有,分析選項分析判斷.
解答 解:某溶液可能含有Cl-、SO42-、CO32-、HCO3-、NH4+、Fe3+、Ba2+和K+,取該溶液100mL,加入過量NaOH溶液加熱,得到0.02mol氣體,判斷為氨氣,NH4++OH-=NH3↑+H2O,溶液中一定含NH4+,物質的量為0.02mol,同時產生1.97g白色沉淀,分析可知溶液中一定含Ba2+,則一定不含SO42-、CO32-、Fe3+,白色沉淀為BaCO3,是碳酸氫根離子和氫氧化鈉反應生成碳酸根離子結合鋇離子生成的碳酸鋇白色沉淀,向上述濾液中加足量BaCl2溶液,也得到1.97g沉淀是碳酸鋇沉淀,則碳酸氫根離子物質的量=$\frac{1.97g}{197g/mol}$+$\frac{1.97g}{197g/mol}$=0.02mol,原溶液中Ba2+物質的量=$\frac{1.97g}{197g/mol}$=0.01mol,結合溶液中電荷守恒分析判斷其他離子是否存在,陽離子:n(NH4+)+2n(Ba2+)=0.02mol+2×0.02mol=0.06mol,n(HCO3-)=0.02mol,則一定含Cl-物質的量最少為0.02mol,K+可能含有,
A.分析可知一定含有的離子HCO3-、NH4+、Ba2+和Cl-,可能含K+,所以溶液中至少存在4種離子,故A錯誤;
B.依據溶液中電荷分析可知,陽離子:n(NH4+)+2n(Ba2+)=0.02mol+2×0.02mol=0.06mol,n(HCO3-)=0.02mol,則一定含Cl-物質的量最少為0.02mol,Cl-一定存在,K+離子可能含有,氯離子濃度最少為:c(Cl-)≥$\frac{0.02mol}{0.1L}$=0.2mol/L,故B正確;
C.SO42-、Fe3+一定不存在,K+、Cl-可能存在,NH4+一定存在,故C錯誤;
D.CO32-一定不存在,HCO3-、NH4+、Ba2+和Cl-一定存在,SO42-、Fe3+一定不存在,故D錯誤;
故選B.
點評 本題考查物質的檢驗及推斷,為高考常見題型和高頻考點,題目難度中等,試題側重于元素化合物知識的綜合理解和運用的考查,注意常見離子的性質和反應類型的判斷,答題時認真閱讀、分析題中數據,合理分析,特別是氯離子的推斷.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
| 容器編號 | 溫度(℃) | 起始物質的量(mol) | 平衡物質的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
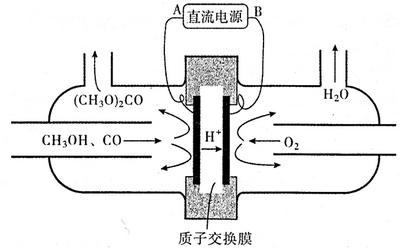
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 一定條件下,在體積為2L的密閉容器中,一氧化碳與氫氣在催化劑作用反應生成甲醇:CO(g)+2H2(g)?CH3OH(g).根據題意完成下列各題:
一定條件下,在體積為2L的密閉容器中,一氧化碳與氫氣在催化劑作用反應生成甲醇:CO(g)+2H2(g)?CH3OH(g).根據題意完成下列各題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蒸發操作時,應使混合物中的水分大部分蒸干后,停止加熱,利用余熱蒸干 | |
| B. | 蒸餾操作時,應使溫度計水銀球靠近蒸餾燒瓶的支管口處 | |
| C. | 濃硫酸稀釋時,應該將水緩緩加入盛濃硫酸的燒杯中,邊加邊攪拌 | |
| D. | 萃取分液時,分液漏斗下層液體從下口放出,上層液體從上口倒出 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用的實驗儀器是容量瓶和燒杯 | |
| B. | 靜置后所得液體上層呈紫紅色 | |
| C. | 碘在CCl4中的溶解度比在水中的溶解度小 | |
| D. | 如果把CCl4加入碘的不飽和水溶液中,萃取碘的實驗也可以成功 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
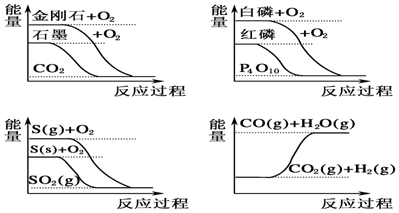
| A. | CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 | |
| B. | S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2,則△H1>△H2 | |
| C. | 白磷比紅磷穩定 | |
| D. | 石墨轉變為金剛石是吸熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol/L的(NH4)2SO4溶液:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1 mol/L的NaHCO3溶液:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| C. | 將0.2 mol/L NaA溶液和0.1 mol/L鹽酸等體積混合所得溶液:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 0.02mol/L CH3COOH溶液和0.01 mol/L NaOH溶液等體積混合所得溶液:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol苯酚中“C═C”的個數為3 NA | |
| B. | 常溫常壓下,22.4L丙烷所含有的共價鍵數目為10NA | |
| C. | 標準狀況下,1L戊烷充分燃燒后生成的氣態產物的分子數為$\frac{5}{22.4}$ NA | |
| D. | 2.8g乙烯和丙烯的混合氣體中所含碳原子數為0.2NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com