
【題目】下列關于物質分離提純的描述不正確的是

A.分離KCl和MnO2混合物的步驟:加水溶解、過濾,濾渣洗滌后干燥,濾液蒸發結晶
B.蒸餾提純時溫度計的位置如圖1所示,收集的產品中混有低沸點雜質
C.NaCl晶體中混有少量KNO3雜質的分離方法為:加水溶解、蒸發結晶、趁熱過濾、洗滌、干燥
D.萃取溴水時,加入適量CCl4,轉移至分液漏斗中,如圖2,用力振搖
【答案】D
【解析】
A. KCl易溶于水,MnO2難溶于水,分離KCl和MnO2混合物應用過濾法,步驟:加水溶解、過濾,濾渣洗滌后干燥,濾液蒸發結晶,故A正確;
B. 蒸餾時,溫度計是測量從蒸餾燒瓶的支管口出去的蒸汽的溫度,蒸餾提純時溫度計的位置如圖1所示,收集的產品中混有低沸點雜質,故B正確;
C.根據NaCl的溶解度隨溫度變化不大,KNO3 的溶解度隨溫度變化大,NaCl晶體中混有少量KNO3雜質的分離方法為:加水溶解、蒸發結晶、趁熱過濾、洗滌、干燥,KNO3留在母液中,故C正確;
D. 萃取溴水時,加入適量CCl4,轉移至分液漏斗中,塞上玻璃塞,萃取分液時,加入萃取劑后,應使液體混合均勻,兩手分別頂住玻璃活塞,使分液漏斗倒轉過來,不能用力振搖,故D錯誤;
故選D。


 黃岡天天練口算題卡系列答案
黃岡天天練口算題卡系列答案科目:高中化學 來源: 題型:
【題目】氨對人類的生產生活具有重要影響。
(1)氨的制備與利用。
① 工業合成氨的化學方程式是____________。
②氨催化氧化生成一氧化氮反應的化學方程式是___________。
(2)氨的定量檢測。水體中氨氣和銨根離子(統稱氨氮)總量的檢測備受關注。利用氨氣傳感器檢測水體中氨氮含量的示意圖如下:
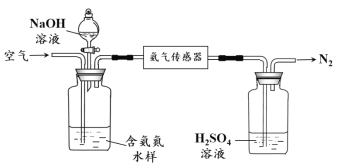
① 利用平衡原理分析含氨氮水樣中加入NaOH溶液的作用:_______________。
② 若利用氨氣傳感器將1 L水樣中的氨氮完全轉化為N2時,轉移電子的物質的量為6×10-4 mol,則水樣中氨氮(以氨氣計)含量為________mg·L-1。
(3)氨的轉化與去除。 微生物燃料電池(MFC)是一種現代化氨氮去除技術。下圖為MFC碳氮聯合同時去除的氮轉化系統原理示意圖。
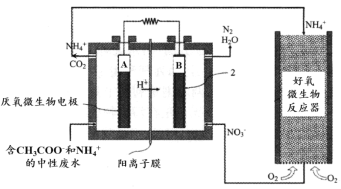
已知A、B兩極生成CO2和N2的物質的量之比為5 : 2,寫出A極的電極反應式:_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
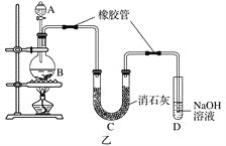
【題目】甲、乙實驗小組設計如下實驗裝置分別制備SnCl4和漂白粉。
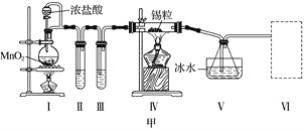
(1)已知:a.金屬錫熔點231 ℃,化學活潑性與鐵相似;
b.干燥的氯氣與熔融金屬錫反應生成SnCl4,SnCl4的沸點114 ℃;
c.SnCl2、SnCl4均易水解,易溶于有機溶劑,且Sn2+易被氧化。根據圖甲裝置回答:
①試管Ⅱ中的試劑是____________________,Ⅲ中的試劑是________________________。
②Ⅵ處裝置最好選用________(填字母)。
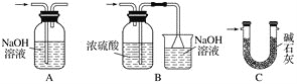
③Ⅰ處裝置中反應的離子方程式是____________________________________________。
④實驗結束后,欲回收利用裝置Ⅰ中未反應完的MnO2,需要的玻璃儀器有______________。
(2)已知:①Cl2與潮濕的消石灰反應是放熱反應;②溫度較高時Cl2與潮濕Ca(OH)2的反應為6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
根據圖乙裝置回答:此實驗所得Ca(ClO)2產率較低的理由是
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖,進行導電性實驗,圖1燈泡不亮,圖2燈泡亮,下列結論正確的是

A.NaCl是非電解質B.NaCl晶體中不存在離子
C.NaCl在水中電離出了可以自由移動的離子D.NaCl溶液是電解質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某固體酸燃料電池以CsHSO4固體為電解質傳遞H+,其基本結構見下圖,電池總反應可表示為:2H2+O2=2H2O,下列有關說法正確的是
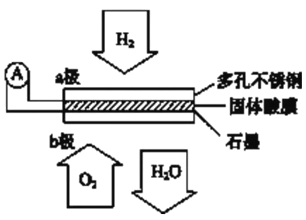
A. 電子通過外電路從b極流向a極
B. b極上的電極反應式為:O2+2H2O+4e--=4OH--
C. 每轉移0.1mol電子,消耗1.12L的H2
D. H+由a極通過固體酸電解質傳遞到b極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】火電站是電力的主要來源之一,火電站是利用煤燃燒進行發電,同時產生污染物。下圖是火電站的工作示意圖:下列敘述不正確的是( )

A.火電站產生的SO2、NO2等氣體能形成酸雨
B.加高火電站的煙囪可減少尾氣中CO的含量
C.靜電沉淀器除塵利用了膠體的性質
D.向煤中加入CaO,可以減少SO2的排放
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)工業上用112 L(標準狀況)氯氣與足量石灰乳反應,制得的漂白粉中有效成分Ca(ClO)2的最大含量為___________mol。
(2)向一定量石灰乳中緩慢通入氯氣,隨著反應的進行,溫度升高,開始產生Ca(ClO3)2。體系中ClO-和ClO3-的物質的量(n)與反應時間(t)的關系曲線如圖1所示(不考慮氯氣和水的反應)。
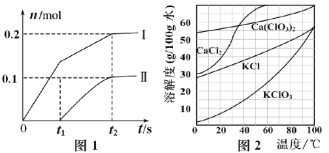
①t2時刻后,溶液中ClO-和ClO3-的物質的量之比為_____________。
②該反應過程中消耗Ca(OH)2的質量為_____________。
(3)向Ca(ClO3)2濃溶液中加入稍過量的KCl固體可轉化為KClO3,如圖2,從該溶液中分離出KClO3固體的實驗方法是________________(不要求填具體操作步驟)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種可充電鋰-空氣電池如圖所示。當電池放電時,O2與Li+在多孔碳材料電極處生成Li2O2-x(x=0或1)。下列說法正確的是

A. 放電時,多孔碳材料電極為負極
B. 放電時,外電路電子由多孔碳材料電極流向鋰電極
C. 充電時,電解質溶液中Li+向多孔碳材料區遷移
D. 充電時,電池總反應為Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量與滴入NaOH溶液的體積關系如圖所示,則原混合液中Al2(SO4)3與MgSO4的物質的量之比為
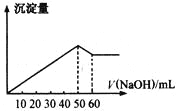
A.6:1B.3:1C.2:1D.1:2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com