
【題目】氫元素與其他元素形成的二元化合物稱為氫化物,下面關于氫化物的敘述正確的是( )
A.一個D2O分子所含的中子數為8B.NH3的結構式為H—![]() —H
—H
C.HCl的電子式為H+[![]() ]D.熱穩定性:H2S>HI
]D.熱穩定性:H2S>HI
【答案】B
【解析】考查的知識點:原子結構、物質結構、元素周期律
A:氫元素有三種常見同位素:H((1H)、D(21H)、T(31H);D2O的中子數為
(2-1)×2+(16-8)=10。所以A錯
B:結構式可以從電子式去演變,也可以根據各原子形成的共價鍵個數去書寫
N原子形成三個共價鍵,H原子形成一個共價鍵,所以NH3的結構式為H—![]() —H
—H
是正確的
C、書寫電子式之前一定要先判斷是離子鍵還是共價鍵
判斷的原理:一般金屬與非金屬元素間形成離子鍵,除了AlCl3等
一般非金屬元素與非金屬元素間形成共價鍵,除了銨鹽等
從上可知,HCl中H和Cl之間形成的是共價鍵而非離子鍵,正確的電子式為H![]()
所以C錯
D、元素的非金屬性越強,氣態氫化物越穩定。由非金屬活動性順序表
F、Cl、Br、I、S(從F到S,元素的非金屬性逐漸減弱)可知:
非金屬性:I> S
氫化物的穩定性:HI > H2S ,所以D錯誤


科目:高中化學 來源: 題型:
【題目】已知:A為正鹽,常溫、常壓下,B、C、D、E、G、H、I均為氣體,其中D、G、H為單質,氣體B能使濕潤紅色石蕊試紙變藍,氣體E本身為無色氣體,但是與空氣接觸會生成一種紅棕色氣體I,H為黃綠色氣體。F在常溫下是一種無色液體。C、J的水溶液分別為兩種強酸。圖中反應條件(除加熱外)均已略去。
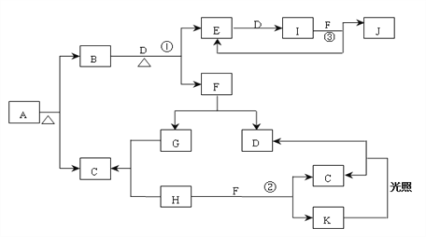
⑴寫出它們的化學式: A________、C________、J________;
⑵實驗室制備氣體B的化學反應方程式為______;
⑶寫出B+D→E+F的化學反應方程式:______;
⑷ J的濃溶液與單質Ag反應的離子方程式為:______;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,在含有Pb2+、Sn2+的某溶液中,加入過量金屬錫(Sn),發生反應:Sn(s) + Pb2+(aq)![]() Sn2+(aq) + Pb(s),體系中c(Pb2+)和c(Sn2+)變化關系如圖所示。下列判斷正確的是
Sn2+(aq) + Pb(s),體系中c(Pb2+)和c(Sn2+)變化關系如圖所示。下列判斷正確的是

A.往平衡體系中加入金屬鉛后,c(Pb2+)增大
B.往平衡體系中加入少量Sn(NO3)2固體后,c(Pb2+)變小
C.升高溫度,平衡體系中c(Pb2+)增大,說明該反應ΔH>0
D.25 ℃時,該反應的平衡常數K=2.2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從實驗室加熱KClO3與MnO2的混合物制取O2后的剩余物中回收MnO2(已知:MnO2難溶于水)的操作順序正確的是( )
A.溶解、過濾、洗滌、干燥 B.溶解、過濾、蒸發、洗滌
C.溶解、蒸發、洗滌、過濾 D.溶解、洗滌、過濾、干燥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】最近科學家成功地制成了一種新型的碳氧化合物,該化合物晶體中每個碳原子均以四個共價單鍵與氧原子結合為一種空間網狀的無限伸展結構,下列對該晶體敘述錯誤的是( )。
A.該物質的化學式為CO4
B.晶體的熔、沸點高,硬度大
C.晶體中C原子數與C—O鍵數之比為1∶4
D.晶體的空間最小環共由12個原子所構成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“各能級最多容納的電子數,是該能級原子軌道數的二倍”,支撐這結論的理論是
A. 構造原理 B. 泡利不相容原理
C. 洪特規則 D. 能量最低原理
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】任何科學真理的發現,都不是一帆風順的,門捷列夫的元素周期表奠定了現代化學和物理學的理論基礎.下列關于元素周期表的說法中,不正確的是( )
A.周期表中的副族、Ⅷ族都是金屬元素
B.周期表中的ⅡA族都是金屬元素
C.周期表中的非金屬元素都位于短周期
D.周期表中的0族元素都是非金屬元素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學—選修3:物質結構與性質】
硒(Se)是一種有抗癌、抗氧化作用的元素,可以形成多種化合物。
(1)基態硒原子的價層電子排布式為 。
(2)鍺、砷、硒的第一電離能大小排序為 。H2SeO4的酸性比H2SeO3的強,其原因是 。
(3)H2SeO3的中心原子雜化類型是 ;SeO32- 的立體構型是 。與SeO32- 互為等電體的分子有(寫一種物質的化學式即可) 。
(4)H2Se屬于 (填“極性”或“非極性”)分子;單質硒的熔點為217℃,它屬于 晶體。
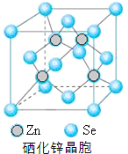
(5)硒化鋅(SnSe)是一種重要的半導體材料,其晶胞結構如圖所示,該晶胞中硒原子的配位數為 ;若該晶胞密度為ρgcm-3,硒化鋅的摩爾質量為M g/mol。NA代表阿伏加德羅常數,則晶胞參數a為 pm。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com