
【題目】某氯化鎂溶液的密度為1.1 g·mL-1,其中鎂離子的質量分數為4.8%,100 mL該溶液中Cl-的物質的量約為( )
A. 0.37 mol B. 0.63 mol
C. 0.74 mol D. 0.44mol
科目:高中化學 來源: 題型:
【題目】物質分類是化學研究的重要方法之一。化學工作者經常根據物質的組成對物質進行分類研究。近年來發現,在金星大氣層中存在三氧化二碳。下列物質與它屬于同類的是( )
A.H2、O3
B.H2SO4、H2CO3
C.SO2、NO
D.Na2SO3、KClO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于金屬元素的特征敘述,正確的是( )
A.金屬元素的原子只有還原性、金屬離子只有氧化性
B.金屬元素在化合物中一定顯正價
C.金屬元素在不同化合物中的化合價都相同
D.金屬元素的單質在常溫下都呈固態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的說法正確的是
A. 2-甲基丁烷也稱異丁烷 B. 由乙烯生成乙醇屬于加成反應
C. C4H9Cl有3中同分異構體 D. 油脂和蛋白質都屬于高分子化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,按要求填空(均填元素符號或化學式):
周期 族 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
4 | ⑩ |
(1)⑧位于元素周期表中第_______周期第_______ 族。
(2)在這些元素中,最活潑的非金屬元素是______(填元素符號);元素的最高價氧化物對應水化物中,堿性最強的是______(填化學式)。
(3)④的單質和②的單質在點燃條件下生成物的電子式是_______;⑨的氣態氫化物和溴化氫相比,較穩定的是___________(寫化學式)。
(4)⑥與⑨形成的化合物和水反應,生成一種弱酸和一種強酸,該反應的化學方程式是________________。
(5)元素①的氣態氫化物與其最高價氧化物的水化物反應的化學方程式_________________。
(6)⑨的單質與⑩的最高價氧化物的水化物反應的離子方程式為___________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅是生物體必需的微量元素,也是人類最早使用的金屬之一。銅的生產和使用對國計民生各個方面都產生了深遠的影響。
(1)為了保護環境和節約資源,通常先用H2O2和稀硫酸的混合溶液溶出廢舊印刷電路板中的銅,最終實現銅的回收利用。寫出H2O2和稀硫酸的混合溶液與金屬銅反應的離子方程式:____________________________________。
(2)工業上以黃銅礦為原料,采用火法熔煉工藝生產銅。該工藝的中間過程會發生反應:2Cu2O+Cu2S![]() 6Cu+SO2↑,該反應的氧化劑是________;當生成19.2 g Cu 時,反應中轉移的電子為________ mol。
6Cu+SO2↑,該反應的氧化劑是________;當生成19.2 g Cu 時,反應中轉移的電子為________ mol。
(3)研究性學習小組用“間接碘量法”測定某試樣中CuSO4·5H2O(不含能與I-反應的氧化性雜質)的含量。稱取a g試樣配成 100 mL 溶液,取出25.00 mL溶液,向其中滴加 KI 溶液后有白色沉淀生成(發生的反應為2Cu2++4I-===2CuI↓+I2);繼續滴加 KI 溶液至沉淀不再產生,反應生成的 I2 與V mL c mol·L-1Na2S2O3溶液恰好完全反應(發生的反應為I2+2Na2S2O3===2NaI+Na2S4O6)。則試樣中CuSO4·5H2O的質量分數為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組探究濃、稀硝酸氧化性的相對強弱,按下圖裝置進行實驗(夾持儀器已略去)。實驗表明濃硝酸能將NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的結論是濃硝酸的氧化性強于稀硝酸。
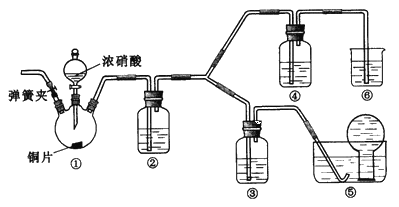
可選藥品:濃硝酸、3mol/L稀硝酸、蒸餾水、濃硫酸、氫氧化鈉溶液及二氧化碳
已知:氫氧化鈉溶液不與NO反應,能與NO2反應:2NO2+2NaOH=NaNO3+NaNO2+H,2O
(1)裝置①中發生反應的離子方程式是_______________________________________________________;
(2)裝置②的目的是____________________,發生反應的化學方程式是____________________________________;
(3)實驗應避免有害氣體排放到空氣中,裝置③、④、⑥中盛放的藥品依次是____________;
(4)實驗的具體操作是:先檢驗裝置的氣密性,再加入藥品,然后____________________,__________________
(此操作的目的是_______________________________________________),最后滴加濃硝酸;
(5)該小組得出的結論所依據的實驗現象是________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應①Fe(s)+CO2(g)![]() FeO(s)+CO(g) △H1=a kJ/mol;
FeO(s)+CO(g) △H1=a kJ/mol;
②CO(g)+1/2O2(g)![]() CO2(g) △H2=b kJ/mol
CO2(g) △H2=b kJ/mol
測得在不同溫度下,反應①的平衡常數K值隨溫度的變化如下:

(1)若500℃時進行反應①,CO2起始濃度為2 mol·L-1,CO的平衡濃度為__________。
(2)反應①中的a______0(填“大于”“小于”或“等于”)。
(3)700℃反應①達到平衡,要使該平衡正向移動,其他條件不變時,可以采取的措施有_______(填序號)
A.縮小反應器體積 B.通入CO2
C.升高溫度到900℃ D.使用合適的催化劑
(4)下列圖像符合反應①的是____(填序號)(圖中v是速率、![]() 為混合物中CO含量,T為溫度且T1> T2)
為混合物中CO含量,T為溫度且T1> T2)

(5)2Fe(s)+O2(g)![]() 2FeO(s) △H3,該反應的△H3=____________kJ/mol。(用含a、b的代數式表示)
2FeO(s) △H3,該反應的△H3=____________kJ/mol。(用含a、b的代數式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z三種短周期元素,原子半徑的大小關系為:r(y)>r(x)>r(z),原子序數之和為16。X、Y、Z三種元素的常見單質在適當條件下可發生下圖所示變化,其中B和C均為10電子分子。下列說法不正確的是
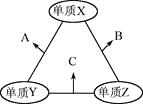
A. X元素位于ⅥA
B. A不能溶解于B中
C. B的沸點高于C的沸點
D. A和C不可能發生氧化還原反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com