
恒容密閉容器中,某化學反應2A![]() B+D在四種不同條件下進行,B、D起始濃度為0,反應物A的濃度(mol/L)隨反應時間(min)的變化情況如下表:
B+D在四種不同條件下進行,B、D起始濃度為0,反應物A的濃度(mol/L)隨反應時間(min)的變化情況如下表:
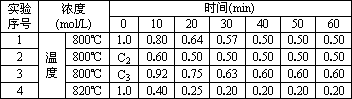
根據上述數據,完成下列填空:
(1)在實驗1,反應在前20 min內用B的濃度變化來表示的平均速率為________mol/(L·min).
(2)在實驗2,A的初始濃度c2=________mol/L,反應在20分鐘內就達到平衡,可推測實驗2中還隱含的條件是________.
(3)設實驗3的反應速率為υ3,實驗1的反應速率為υ1(用同種物質的濃度變化表示),則達到平衡時υ3________υ1(填>、=、<=)且c3=________mol/L.
(4)比較實驗4和實驗1,可推測該反應是________反應(選填“吸熱”、“放熱”).
(5)800℃時,反應2A![]() B+D的平衡常數=________,實驗2中達到平衡時A的轉化率=________.
B+D的平衡常數=________,實驗2中達到平衡時A的轉化率=________.
 黃岡經典趣味課堂系列答案
黃岡經典趣味課堂系列答案 啟東小題作業本系列答案
啟東小題作業本系列答案科目:高中化學 來源: 題型:閱讀理解
 CH3OH(g)△H
CH3OH(g)△H| 溫度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
| V2 |
| a2 |
| V2 |
| a2 |
| 容器 | 甲 | 乙 | 丙 | |
| 反應物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 時 的 數 據 |
CH3OH濃度(mol/L) | c1 | c2 | c3 |
| 反應的能量變化 | akJ | bkJ | ckJ | |
| 體系壓強(Pa) | p1 | p2 | p3 | |
| 反應物轉化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(19分)工業上一般在恒容密閉容器中用H2和CO生產燃料甲醇,反應方程式為
CO(g)+2H2(g)CH3OH(g)△H
(1)下表所列數據是反應在不同溫度下的化學平衡常數(K)。
| 溫度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
①由表中數據判斷△H 0(填“>”、“=”或“<“)
②某溫度下,將2molCO和6molH2充入2L的密閉容器中,充分反應后,達到平衡時測得c(CO)=0.2mol/L,則CO的轉化率為 ,此時的溫度為 。
(2)在100℃ 壓強為0.1 MPa條件下,容積為V L某密閉容器中a mol CO與 2a mol H2在催化劑作用下反應生成甲醇,達平衡時CO的轉化率為50%,則100℃該反應的的平衡常數K= (用含a、V的代數式表示并化簡至最簡單的形式)。此時保持溫度容積不變,再向容器中充入a mol CH3OH(g),平衡___ __(向正反應方向、向逆反應方向)移動,再次達到新平衡時,CO的體積分數 。(減小、增大、不變)
(3)要提高CO的轉化率,可以采取的措施是 。
A.升溫 B.加入催化劑 C.增加CO的濃度
D.恒容充入H2 E.恒壓充入惰性氣體 F.分離出甲醇
(4)判斷反應達到平衡狀態的依據是(填字母序號,下同) 。
A.生成CH3OH的速率與消耗CO的速率相等
B.混合氣體的密度不變
C.混合氣體的平均相對分子質量不變
D.CH3OH、CO、H2的濃度都不再發生變化
(5)300°C,在容積相同的3個密閉容器中,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡的有關數據如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反應物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 時 的 數 據 | CH3OH濃度(mol/L) | c1 | c2 | c3 |
| 反應的能量變化 | akJ | bkJ | ckJ | |
| 體系壓強(Pa) | p1 | p2 | p3 | |
| 反應物轉化率 | α1 | α2 | α3 |
請選擇正確的序號填空(不定項選擇)
① c1、c2、c3的關系表達正確的為______
A c3>2c1 B c1<c3<2c1 C c1=c2
②p1、p2、p3的關系不正確的為________
A p1=p2 B p2<p3<2p2 C p3>2p2
③ a1、a2、a3的關系表達不正確的為________
A a1=a2 B a3< a2 C a1+a2=1
查看答案和解析>>
科目:高中化學 來源:2013-2014學年山東省臨沂市高三3月教學質量檢測(一模)化學試卷(解析版) 題型:填空題
化學反應原理在科研和生產中有廣泛應用。
(1)利用“化學蒸氣轉移法”提純金屬鎢的反應原理為W(s)+I2(g) WI2(g) (I)。該反應在石英真空管中進行,如下圖所示:
WI2(g) (I)。該反應在石英真空管中進行,如下圖所示:
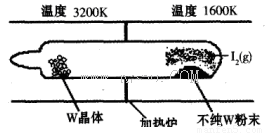
①反應(I)的平衡常數表達式K=_______,若K= ,向某恒容密閉容器中加入1mol I2(g)和足量W(s),反應達到平衡時I2(g)的轉化率為__________。
,向某恒容密閉容器中加入1mol I2(g)和足量W(s),反應達到平衡時I2(g)的轉化率為__________。
②反應(I)的△H____0(填“>”或“<”),上述反應體系中可循環使用的物質是_________。
③能夠說明上述反應已經達到平衡狀態的有_________(填序號)。
a.I2與WI2的濃度相等
b.W的質量不再變化
c.容器內混合氣體的密度保持不變
d.單位時間內,金屬鎢消耗的物質的量與碘化鎢生成的物質的量相等
(2)25℃時,NaHSO3的水解平衡常數=1.0×10-12mol/L,則該溫度下H2SO3 HSO3-+H+的電離常數Ka=____mol/L,若向H2SO3溶液中加入少量的I2,則溶液中
HSO3-+H+的電離常數Ka=____mol/L,若向H2SO3溶液中加入少量的I2,則溶液中 將________(填“增大”、“減小”或“不變”)。
將________(填“增大”、“減小”或“不變”)。
(3)直接排放含SO2的煙氣會形成酸雨,危害環境。用Na2SO3溶液吸收SO2的過程中,pH隨n(SO32-):n(HSO3-)變化關系如下表:
n(SO32-): n ( HSO3-) | 91:9 | 1:1 | 1:91 |
pH(25℃) | 8.2 | 7.2 | 6.2 |
當吸收液呈中性時,溶液中離子濃度由大到小的順序為_________________________。
查看答案和解析>>
科目:高中化學 來源:2013屆山東省高二上學期模塊檢測化學試卷 題型:填空題
(12分) 恒容密閉容器中,某化學反應2A  B+D在四種不同條件下進行,B、D起始濃度為0,反應物A的濃度(mol/L)隨反應時間(min)的變化情況如下表:
B+D在四種不同條件下進行,B、D起始濃度為0,反應物A的濃度(mol/L)隨反應時間(min)的變化情況如下表:
|
實驗序號 |
濃度(mol/L) |
時間(min) |
|||||||
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|||
|
1 |
溫 度 |
8000C |
1.0 |
0.80 |
O.64 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
8000C |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
|
3 |
8000C |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
|
4 |
8200C |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根據上述數據,完成下列填空:
(1)在實驗1,反應在前20min內用B的濃度變化來表示的平均速率
為 mol/(L·min)。
(2)在實驗2,A的初始濃度c2= mol/L,反應在 20分鐘內就達到
平衡,可推測實驗2中還隱含的條件是 。
(3)設實驗3的反應速率為υ3,實驗1的反應速率為υ1(用同種物質的濃度變
化表示),則達到平衡時υ3 υ1(填>、=、<=)
且c3 = mol/L。
(4)比較實驗4和實驗1,可推測該反應是 反應(選填“吸熱”、“放熱”)。
(5) 800℃時,反應2A  B+D的平衡常數=
,
B+D的平衡常數=
,
實驗2中達到平衡時A的轉化率= 。
查看答案和解析>>
科目:高中化學 來源: 題型:
恒容密閉容器中,某化學反應2A ![]() B+D在四種不同條件下進行,B、D
B+D在四種不同條件下進行,B、D
起始濃度為0,反應物A的濃度(mol/L)隨反應時間(min)的變化情況如下表:
| 實驗序號 | 濃度(mol/L) | 時間(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 溫 度 | 8000C | 1.0 | 0.80 | O.64 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 8000C | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 8000C | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 8200C | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
根據上述數據,完成下列填空:
(1)在實驗1,反應在前20min內用B的濃度變化來表示的平均速率
為 mol/(L·min)。
(2)在實驗2,A的初始濃度c2= mol/L,反應在 20分鐘內就達到
平衡,可推測實驗2中還隱含的條件是 。
(3)設實驗3的反應速率為υ3,實驗1的反應速率為υ1(用同種物質的濃度變
化表示),則達到平衡時υ3 υ1(填>、=、<=)
且c3 = mol/L。
(4)比較實驗4和實驗1,可推測該反應是 反應(選填“吸熱”、“放熱”)。
(5) 800℃時,反應2A ![]() B+D的平衡常數= ,
B+D的平衡常數= ,
實驗2中達到平衡時A的轉化率= 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com