
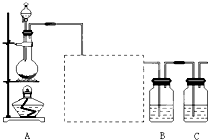
 ,故答案為:飽和食鹽水;除去Cl2中的HCl氣體;
,故答案為:飽和食鹽水;除去Cl2中的HCl氣體;

 快樂5加2金卷系列答案
快樂5加2金卷系列答案科目:高中化學 來源: 題型:
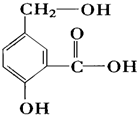 (1)用工業酒精制造的假酒中通常含有
(1)用工業酒精制造的假酒中通常含有查看答案和解析>>
科目:高中化學 來源: 題型:
| 實驗步驟 | 實驗現象 |
| ①將鎂條用砂紙打磨后,放入試管中,加入少量水后,加熱至水沸騰;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四處游動,發出“嘶嘶”聲,隨之消失,溶液變成紅色 |
| ②將一小塊金屬鈉放入滴有酚酞溶液的冷水中 | B.有氣體產生,溶液變成淺紅色 |
| ③將鎂條投入稀鹽酸中 | C.反應不十分劇烈;產生無色氣體 |
| ④將鋁條投入稀鹽酸中 | D.劇烈反應,迅速產生大量無色氣體 |
| 實驗內容 | ① | ② | ③ | ④ |
| 實驗現象(填A~D) |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
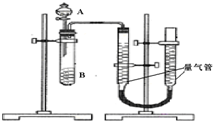 甲、乙兩個實驗小組利用KMnO4酸性溶液與H2C2O4溶液反應研究影響反應速率的因素.該反應的離子方程式為2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.設計實驗方案如下(實驗中所用KMnO4溶液均已加入H2SO4):
甲、乙兩個實驗小組利用KMnO4酸性溶液與H2C2O4溶液反應研究影響反應速率的因素.該反應的離子方程式為2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.設計實驗方案如下(實驗中所用KMnO4溶液均已加入H2SO4):| 序號 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |

| 實驗編號 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 時間/s | 40 | 20 | 10 | --- |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 容器 | 甲 | 乙 | 丙 |
| 反應物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的濃度(mol/L) | c1 | c2 | c3 |
| 反應的能量變化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 反應物轉化率 | α 1 | α 2 | α 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、混合氣體壓強不再發生變化 |
| B、混合氣體質量不再發生變化 |
| C、反應中CO與H2的物質的量之比為1:1 |
| D、生成nmolCO的同時生成nmolH2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com