
下列各組元素的性質正確的是( )
A. 第一電離能:B>Al>Ga
B. 電負性:F>N>O
C. 最高正價:F>S>Si
D. 原子半徑:P>N>C
科目:高中化學 來源:2017屆湖南省長沙市高三上學期第二次周測化學試卷(解析版) 題型:選擇題
工業上,利用CO和H2合成二甲醚:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) ,為了尋找合適的溫度,研究者進行了多次實驗,每次實驗保持原料氣組成(3mol CO、3mol H2)、體積(10L)、反應時間等因素不變,實驗結果如圖所示。下列說法正確的是
CH3OCH3(g)+CO2(g) ,為了尋找合適的溫度,研究者進行了多次實驗,每次實驗保持原料氣組成(3mol CO、3mol H2)、體積(10L)、反應時間等因素不變,實驗結果如圖所示。下列說法正確的是
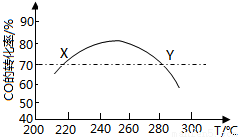
A.X、Y兩點對應的CO正反應速率相等
B.合成二甲醚的正反應△H>0
C.反應溫度控制在240℃~260℃之間
D.選擇合適催化劑,可以提高CO的轉化率
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林長春第十一中高一下期末考化學(解析版) 題型:選擇題
對于合成氨反應,達到平衡后,以下分析正確的是( )
A.升高溫度,對正反應的反應速率影響更大
B.增大壓強,對正反應的反應速率影響更大
C.減小反應物濃度,對逆反應的反應速率影響更大
D.加入催化劑,對逆反應的反應速率影響更大
查看答案和解析>>
科目:高中化學 來源:2017屆河南信陽高考化學暑假自學自測專練:原子結構與性質(解析版) 題型:推斷題
A、B、C、D、E代表5種元素。請填空:
(1) A元素基態原子的最外層有3個未成對電子,次外層有2個電子,其元素名稱為________。
(2) B元素的負一價離子和C元素的正一價離子的電子層結構都與氬相同,B的元素符號為________,C的元素符號為________。
(3) D元素的正三價離子的3d亞層為半充滿,D的元素符號為________,其基態原子的電子排布式為__________________________。
(4) E元素基態原子的M層全充滿,N層沒有成對電子,只有一個未成對電子,E的元素符號為________,其基態原子的電子排布式為________________________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年福建省高一下學期期末化學試卷(解析版) 題型:填空題
烯丙醇是一種無色有刺激性氣味的液體,是重要的有機合成原料,其結構簡式為 CH2=CH—CH2OH。請回答:
(1)烯丙醇中除碳碳雙鍵外還含有的官能團是 (名稱)。
(2)0.1mol 烯丙醇與足量金屬鈉反應,能生成氫氣 L(標準狀況下)。
(3)寫出烯丙醇與溴水反應的化學方程式 ,
(4)烯丙醇與CH3CO18OH發生酯化反應的化方程式為 ,酯化反應生成的產物在一定條件下可以發生加聚反應得到高分子化合物,其結構簡式為 。
(5)烯丙醇的一種同分異構體能發生銀鏡反應,其結構簡式為 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年福建省高一下學期期末化學試卷(解析版) 題型:選擇題
短周期主族元素A、B、C、D,原子序數依次增大。A、C的原子序數之差為8,A、B、C三種元素原子的最外層電子數之和為15,且B原子最外層電子數等于A原子最外層電子數的一半。下列敘述正確的是( )
A. 原子半徑:A<B<C<D B. 最高價氧化物對應水化物的酸性:D<C
C. 非金屬性:A>C D. 單質B常溫下能溶于濃硝酸
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣東省揭陽市高二期末統考理綜化學試卷(解析版) 題型:實驗題
某化學興趣小組設計如下實驗方案。將濃硫酸與銅片反應制備SO2并進行相關實驗探究,實驗裝置如下圖所示:
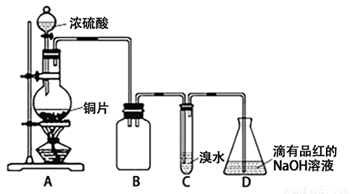
請回答下列問題:
(1)裝置B的作用是 。
(2)設計裝置C的目的是驗證SO2的 性,裝置C中發生反應的離子方程式是 。裝置D中NaOH全部轉化為NaHSO3的標志是 。
(3)向NaHSO3溶液中加入NaClO溶液時,反應有三種可能的情況:
I.HSO3-與ClO-恰好反應
Ⅱ.NaClO不足
Ⅲ.NaClO過量
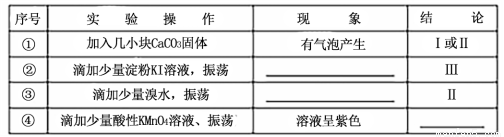
甲同學分別取上述混合溶液于試管中,通過下列實驗確定該反應屬于哪一種情況,請完成下表:(已知酸性:H2SO3>H2CO3>HClO)
(4)請設計簡單實驗證明:室溫下HSO3-的電離平衡常數Ka與水解平衡常數Kb的相對大小: 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧省錦州市高一下學期期末統考化學試卷(解析版) 題型:選擇題
下圖是元素周期表的一部分,下列說法正確的是

A. 離子半徑:W->X+>Y3-
B. 可在灰色區域“甲”中尋找催化劑
C. 氣態氫化物的穩定性:Z>W
D. 工業上電解 X和 W化合物的水溶液制備 X
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com