
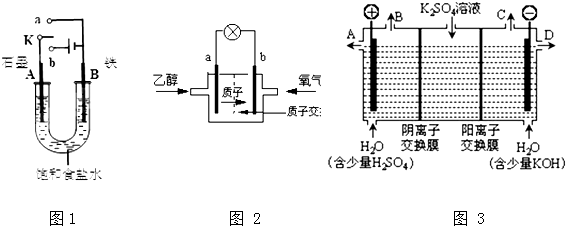
分析 (1)①開始時開關K與a連接形成原電池反應,發生吸氧腐蝕,B電極鐵做負極失電子生成亞鐵離子,A電極石墨做正極溶液中氧氣得到電子生成氫氧根離子;
②開始時開關K與b連接形成電解池,與電源正極相連的A電極為陽極,溶液中氯離子失電子生成氯氣,與電源負極相連的B電極為電解池的陰極,溶液中氫離子得到電子生成氫氣,電解氯化鈉溶液生成氫氧化鈉、氫氣和氯氣;
(2)在燃料電池中,燃料在負極發生失電子的反應,電流在電路中從正極流向負極;
(3)電解時,溶液中的氫氧根離子的放電能力大于硫酸根離子的放電能力,陽極上失電子發生氧化反應,電解產生的氫氧化鉀在陰極產生.
解答 解:(1)①開始時開關K與a連接形成原電池反應,發生吸氧腐蝕,A電極石墨做正極溶液中氧氣得到電子生成氫氧根離子,電極反應為:O2+2H2O+4e-=4OH-,
故答案為:原電池;O2+2H2O+4e-=4OH-;
②開關K與b連接,裝置為電解池,鐵為陰極,發生還原反應,氫離子得到電子生成氫氣,即B電極反應為2H++2e-=H2↑;電解飽和食鹽水生成氫氧化鈉、氫氣和氯氣,電解總反應的離子方程式為2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案為:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$2OH-+H2↑+Cl2↑;
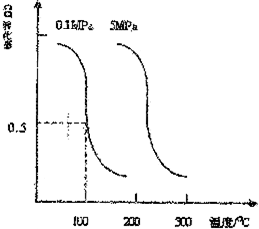
(2)①燃料電池中,燃料乙醇在負極發生失電子的反應,氧氣是在正極上發生得電子的反應,電流在電路中從正極流向負極,根據質子移動方向,可以知道b是正極,a是負極,故答案為:b;b→a;
②該電池負極的電極反應式為:C2H5OH+3H2O-12e-=2CO2+12H+,故答案為:C2H5OH+3H2O-12e-=2CO2+12H+;
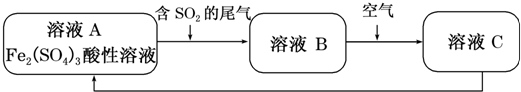
(3)①電解時,陰極上氫離子得電子發生還原反應,電極反應式為:2H++2e-=H2↑,故答案為:2H++2e-=H2↑;
②陽極上失電子發生氧化反應,溶液中的氫氧根離子的放電能力大于硫酸根離子的放電能力,所以陽極上氫氧根離子失電子生成水和氧氣4OH--4e-=2H2O+O2↑,陽極氫氧根離子放電,因此硫酸根離子向陽極移動,該電極上會產生硫酸,陰極氫離子放電,因此鉀離子向陰極移動,電解產生的氫氧化鉀在陰極生成,所以氫氧化鉀溶液從出口D流出,制得的硫酸溶液從A口流出,
故答案為:A;陽極上氫氧根離子失電子生成水和氧氣4OH--4e-=2H2O+O2↑,陽極氫氧根離子放電,因此硫酸根離子向陽極移動,該電極上會產生硫酸.
點評 本題考查原電池和電解池知識,題目難度中等,本題注意把握根據電池總反應書寫電極方程式的方法.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 研究和開發CO2 和CO的創新利用是環境保護和資源利用的雙贏的課題.
研究和開發CO2 和CO的創新利用是環境保護和資源利用的雙贏的課題.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 組成物質分別是 | |||||
| 質 量 為(g) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 室溫下,PH=2的溶液中:Fe2+、SO42-、Na+、NO3- | |
| C. | 無色透明的溶液中:NH4+、Cl-、NO3-、Fe3+ | |
| D. | 使紅色石蕊試紙變藍的溶液中:SO32-、Na+、CO32-、K+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向C溶液中滴加KSCN溶液,溶液變為血紅色 | |
| B. | 溶液B轉化為溶液C發生的變化的離子方程式為4H++2Fe2++O2═2Fe3++2H2O | |
| C. | 溶液酸性A>B>C | |
| D. | 加氧化亞鐵可以使溶液C轉化為溶液A |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
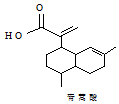
| A. | 青蒿酸的分子式為C15H20O2 | |
| B. | 1mol青蒿酸最多可與3molH2加成 | |
| C. | 青蒿酸與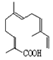 互為同分異構體 互為同分異構體 | |
| D. | 苯環上連有-CHO和-OH、分子中有6種不同化學環境氫的青蒿酸的同分異構體只有2種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氨水應密閉保存,放置于低溫處 | |
| B. | 對2HI(g)?H2(g)+I2(g)平衡體系,增大平衡體系的壓強可使氣體顏色變深 | |
| C. | 生產硝酸的過程中使用過量空氣以提高氨氣的利用率 | |
| D. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,當加入AgNO3溶液后,溶液顏色變淺 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com