
分析 (1)乙二酸分子中含有羧基,有酸性能發生酯化反應、能被高錳酸鉀氧化;
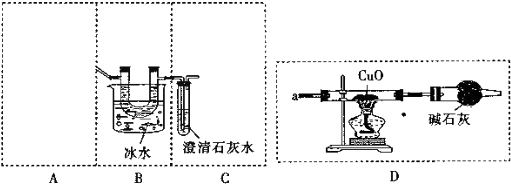
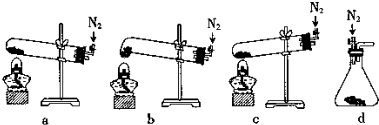
(2)①由于試管口向下傾斜,草酸晶體熔點較低,加熱到182℃便開始熔化,因此實驗中會出現熔融的草酸流進導管而影響后續實驗,能避免熔融的草酸流進導管而影響后續實驗;
②裝置氣密性檢驗,先密閉裝置,最后的導氣管插入水中,微熱后,有氣泡冒出,冷卻后導氣管會有水柱上升,證明裝置氣密性完好;
③草酸晶體在101℃時熔化并開始升華,157℃時大量升華,草酸和氫氧化鈣也反應生成草酸鈣白色沉淀分析;
(3)①C中盛放Ba(OH)2 溶液,而不使用澄清石灰水,氫氧化鋇溶解度大于氫氧化鈣,利用的是氫氧化鋇吸收二氧化碳充分,碳酸鋇摩爾質量大于碳酸鈣,測得誤差小;
②緩緩通入N2,把生成的氣體全部趕入CD中全部吸收,減少測得誤差;
③若取草酸晶體的質量為15.0g,C中沉淀的質量為19.7g,為碳酸鋇沉淀,計算得到二氧化碳中碳元素物質的量,裝置D中硬質玻璃管減少的質量為1.6g,說明生成了一氧化碳,依據反應定量關系計算一氧化碳物質的量,依據碳元素守恒得到草酸晶體中草酸質量,得到含有結晶水的質量,依據原子守恒計算書寫化學方程式;
解答 解:(1)乙二酸分子中含有羧基,具有酸性,且酸性比碳酸強,能使藍色石蕊試液變紅,能與碳酸氫鈉反應生成二氧化碳;能與乙二醇發生發生酯化反應;能被酸性高錳酸鉀氧化而使高錳酸鉀溶液褪色,所以四個選項都正確,
故答案為:①②③④;
(2)①由于試管口向下傾斜,草酸晶體熔點較低,加熱到182℃便開始熔化,因此實驗中會出現熔融的草酸流進導管而影響后續實驗,能避免熔融的草酸流進導管而影響后續實驗,裝置最好應該選擇下列裝置中的b,
故答案為:b;
②裝置氣密性檢驗,先密閉裝置,最后的導氣管插入水中,微熱后,有氣泡冒出,冷卻后導氣管會有水柱上升,證明裝置氣密性完好,如圖連接好裝置,關閉裝置A的活塞,將C裝置中的導管沒入水中,微熱A裝置的試管,看到導氣管口處有氣泡冒出,撤火后觀察到導氣管中有一段水柱上升,則說明裝置氣密性完好,
故答案為:裝置氣密性檢驗,先密閉裝置,最后的導氣管插入水中,微熱后,有氣泡冒出,冷卻后導氣管會有水柱上升,證明裝置氣密性完好;
③草酸晶體在101℃時熔化并開始升華,157℃時大量升華,草酸和氫氧化鈣也反應生成草酸鈣白色沉淀分析,若無B裝置,當c裝置中出現渾濁,不能說明草酸分解生成了CO2,
故答案為:不能;草酸和氫氧化鈣也反應生成草酸鈣白色沉淀;
(3)①C中盛放Ba(OH)2 溶液,而不使用澄清石灰水,氫氧化鋇溶解度大于氫氧化鈣,利用的是氫氧化鋇吸收二氧化碳充分,碳酸鋇摩爾質量大于碳酸鈣,測得誤差小,
故答案為:Ba(OH)2 溶解度大于氫氧化鈣可充分吸收二氧化碳,碳酸鋇摩爾質量大于碳酸鈣,測量誤差小;
②緩緩通入N2,把生成的氣體全部趕入CD中全部吸收,減少測得誤差,
故答案為:使草酸分解生成的氣體全部鋇裝置CD全部吸收;
③若取草酸晶體的質量為15.0g,C中沉淀的質量為19.7g,為碳酸鋇沉淀物質的量=$\frac{19.7g}{197g/mol}$=0.1mol,計算得到二氧化碳中碳元素物質的量為0.1mol,裝置D中硬質玻璃管減少的質量為1.6g,減少的是氧元素質量,物質的量=$\frac{1.6g}{16g/mol}$=0.1mol,依據反應定量關系計算一氧化碳物質的量,說生成了一氧化碳為0.1mol,依據碳元素守恒得到草酸晶體中草酸質量=(0.1mol+0.1mol)×$\frac{1}{2}$×90g/mol=9g,得到含有結晶水的質量=15g-9g=6g,水的物質的量=$\frac{6g}{18g/mol}$=$\frac{1}{3}$mol,n(CO2):n(CO):n(H2O)=0.1:0.1:$\frac{1}{3}$≈1:1:3,依據原子守恒計算書寫化學方程式:H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+3H2O+CO↑,
故答案為:H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+3H2O+CO↑.
點評 本題通過探討乙二酸的性質,考查了物質性質實驗方案的設計,題目難度較大,正確理解題干信息明確反應原理為解答關鍵,計算過程稍復雜,可以假設出草酸氫銨的物質的量,然后根據反應原理計算,試題充分考查了學生的分析、理解能力及化學實驗、化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | ①③ | B. | ②④⑤ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | SiHCl3 | SiCl4 | AsCl3 |
| 沸點/℃ | 32.0 | 57.5 | 131.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 四種元素中,最高價氧化物的水化物酸性:Z的最強 | |
| B. | 氫化物穩定性:Y的最強 | |
| C. | 原子半徑由小到大順序:Y<Z<M<X | |
| D. | 同周期元素中M元素原子失電子最多,其單質的還原性最強 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com