
【題目】分子式為C8H18的烷烴中,含有4個甲基的同分異構體的數目是( )
A.5種
B.6種
C.7種
D.8種
 狀元坊全程突破導練測系列答案
狀元坊全程突破導練測系列答案科目:高中化學 來源: 題型:
【題目】有機合成工業中原子利用率高、原料來源豐富、價格低廉且無污染,稱其為“綠色化學”.以下反應中符合綠色化學原理的是( )
A.乙烯與氧氣在銀催化下生成環氧乙烷 ![]()
B.乙烷與氯氣制備一氯乙烷
C.60℃時,乙炔與水在硫酸汞酸性溶液中合成乙醛
D.乙醇與濃硫酸共熱制備乙烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C1化學是目前研究的熱點問題。
(1)己知:2C(s)+O2(g)=2CO(g) △H =a kJ·mol-1 C(s)+H2O(g)=CO(g)+H2(g) △H =+130kJ·mol-1 H-H、O=O、H-O鍵的鍵能分別為436kJ/mol、496kJ/mol、462kJ/mol。則a=_______。
(2)以甲醇為原料制備H2的一種原理如下:
I.CH3OH(g) ![]() CO(g)+2H2(g) △H =+90kJ·mol-1
CO(g)+2H2(g) △H =+90kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-41kJ·mol-1
CO2(g)+H2(g) △H =-41kJ·mol-1
①在絕熱恒容密閉容器中,加入一定量的CH3OH(g)在一定條件下發生反應I,下列情況能說明該反應達到平衡狀態的是____________(填代號)
A.容器內溫度不變
B.容器內氣體總質量不再變化
C.CH3OH(g)和CO(g)的濃度之比不再變化
D.混合氣體的密度不再變化
②溫度為T℃時,向10L恒容密閉容器中充入1molCH3OH(g)和lmolH2O(g),發生反應I和反應II,達到平衡時測得CO的物質的量為0.4mol,CO2的物質的量為0.2mol。則反應II的平衡常數K=_____。該溫度下,在某時刻平衡體系中c(CO2)=2mol/L、c(H2)=2mol/L、c(CO)=4mol/L、c(H2O)=4mol/L,則該時刻上述反應II的平衡移動方向為__________(填“正反應方向”、“逆反應方向”或“不移動”)。
(3)H2和CO在一定條件(溫度、壓強和催化劑)下合成CH4,發生反應:CO(g)+3H2(g)![]() H4(g)+H2O(g)△H<0。如下圖,溫度低于T0時,隨著溫度升高,CH4的產率增大,其原因是_______________________________________________________________。
H4(g)+H2O(g)△H<0。如下圖,溫度低于T0時,隨著溫度升高,CH4的產率增大,其原因是_______________________________________________________________。
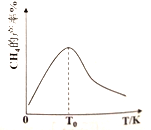
(4)合成氣(H2、CO)不僅是化工原料,也是清潔能源。如果H2和CO以體積比1:1組成混合氣體與空氣構成堿性燃料電池(KOH溶液為電解質溶液且足量),假設CO和H2同時按比例發生反應,則燃料電池負極的電極反應式為____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在1L恒容密閉容器中X,Y,Z三種氣體的物質的量隨時間變化曲線如圖所示,以下說法正確的是( ) 
A.反應開始至2min,反應的平均速率v(Z)=0.2mol/L
B.該反應的化學方程式為X+3Y═2Z
C.該反應平衡時,Y轉化率為30%
D.3min時,充入X,v正增大,v逆減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,在水溶液中發生如下反應:①16H++10C-+2XO![]() ===2X2++5C2+8H2O;②2A2++B2===2A3++2B-;③2B-+C2===B2+2C-。下列說法錯誤的是( )
===2X2++5C2+8H2O;②2A2++B2===2A3++2B-;③2B-+C2===B2+2C-。下列說法錯誤的是( )
A. 反應C2+2A2+===2A3++2C-可以進行
B. 反應③是置換反應
C. 氧化性由強到弱的順序是XO![]() >C2>B2>A3+
>C2>B2>A3+
D. 還原性由強到弱的順序是C->A2+>B->X2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上通過2Al2O3+3C+6Cl2═4AlCl3+3CO2制取無水氯化鋁,下列說法正確的是( )
A. AlCl3是氧化產物
B. Cl2是氧化劑
C. 每生成1 mol CO2,轉移4個電子
D. C發生還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.碳酸氫鈉的熱穩定性比碳酸鈉的強
B.等質量的碳酸鈉、碳酸氫鈉分別與足量的鹽酸反應,前者產生的二氧化碳多
C.足量的碳酸鈉和碳酸氫鈉分別與等物質的量的鹽酸反應,兩者產生的二氧化碳一樣多
D.等物質的量的碳酸鈉和碳酸氫鈉分別與足量鹽酸反應,前者消耗的鹽酸多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知充分燃燒ag乙炔氣體時生成1mol二氧化碳氣體和液態水,并放出熱量bkJ,則乙炔燃燒的熱化學方程式正確的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2bkJ/mol
B.C2H2(g)+ ![]() O2(g)═2CO2(g)+H2O(l)△H=2bkJ/mol
O2(g)═2CO2(g)+H2O(l)△H=2bkJ/mol
C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣4bkJ/mol
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=bkJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D、E五種短周期元素,已知相鄰的A、B、C、D四種元素原子核外共有56個電子,在周期表中的位置如圖所示。E的單質可與酸反應,1molE單質與足量酸作用,在標準狀況下能產生33.6LH2;E的陽離子與A的陰離子核外電子層結構完全相同。

回答下列問題:
(1)A與E形成的化合物的化學式是 。
(2)B的最高價氧化物化學式為 ,C的元素名稱為 ,
D的單質與水反應的方程式為_ 。
(3)向D與E形成的化合物的水溶液中滴入燒堿溶液直至過量,觀察到的現象是 ,有關反應的離子方程式為 ; 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com