
(10分)“酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如圖所示的裝置制取乙酸乙酯。回答下列問題
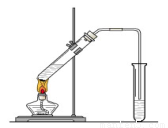
(1)在大試管中按一定比例將乙醇、乙酸混合后充分加熱,在右邊小試管中未收集到有香味的液體(氣密性良好),原因可能是: 。
(2)右邊小試管中應加入的試劑是: ;其作用是 。
(3)下列描述能說明乙醇與乙酸的酯化反應已達到該反應的限度的有(填序號) 。
①單位時間里,生成1mol乙酸乙酯,同時生成1mol水
②單位時間里,生成1mol乙酸乙酯,同時生成1mol乙酸
③單位時 間里,消耗1mol乙醇 ,同時消耗1mol乙酸
,同時消耗1mol乙酸
④正反應的速率與逆反應的速率相等
⑤混合物中各物質的濃度不再變化
(4)海水化學資源的開發利用具有重要的意義和作用,下圖是海帶中提取碘的示意圖:
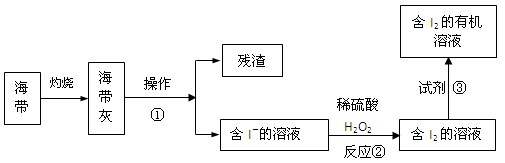
操作①的名稱是 ;反應②的離子方程式是 ,下述物質中可做試劑③的是 。
A.乙醇 B.苯 C.乙酸 D.四氯化碳
(1) 未加催化劑濃硫酸 (1分)
(2) 飽和N a2CO
a2CO 3溶液 (1分)
中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度 。 (2分)
(3) ②④⑤(2分)
3溶液 (1分)
中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度 。 (2分)
(3) ②④⑤(2分)
(4) 過濾 (1分) 2H++2I-+H2O2=I2+2H2O(2分)BD(1分)
【解析】(1)酯化反應需要濃硫酸作催化劑,根據實驗過程可知,實驗失敗的原因是未加催化劑濃硫酸。
(2)由于生成的乙酸乙酯中含有乙酸和乙醇,所以要除去這兩種雜質,需要加入飽和碳酸鈉溶液,目的是中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度,便于分層析出。
(3)在一定條件下,當可逆反應中正反應速率和逆反應速率相等時(但不為0),各種物質的濃度或含量均不再發生變化的狀態,是化學平衡狀態。所以④⑤正確。①③中反應速率的方向是相同的,所以不能說明。②中反應速率的方向是相反的,且滿足反應速率之比是相應的化學計量數之比,可以說明,所以正確的大答案是②④⑤。
(4)海帶灰中含有不溶于水的殘渣,過濾即可。雙氧水具有氧化性,能把碘離子氧化生成單質碘,所以方程式為2H++2I-+H2O2=I2+2H2O。過程③是萃取,乙酸和乙醇與水都是互溶的,不能用作萃取劑,答案是BD。


科目:高中化學 來源: 題型:
 “酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如右圖所示的裝置制取乙酸乙酯.回答下列問題:
“酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如右圖所示的裝置制取乙酸乙酯.回答下列問題: CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 “酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如圖所示的裝置制取乙酸乙酯.回答下列問題:
“酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如圖所示的裝置制取乙酸乙酯.回答下列問題:| 濃硫酸 |
| △ |
| 濃硫酸 |
| △ |
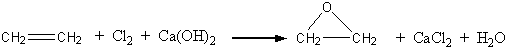
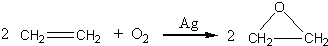
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 “酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用右圖所示的裝置制取乙酸乙酯.回答下列問題:
“酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用右圖所示的裝置制取乙酸乙酯.回答下列問題: CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2O CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2O查看答案和解析>>
科目:高中化學 來源: 題型:
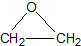
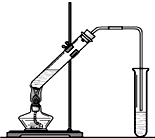 “酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如圖所示的裝置制取乙酸乙酯.回答下列問題:
“酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如圖所示的裝置制取乙酸乙酯.回答下列問題: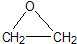 +CaCl2+H2O
+CaCl2+H2O| Ag |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com