
【題目】元素鉻(Cr)在溶液中主要以Cr3+(藍紫色)、Cr(OH)4-(綠色)、Cr2O72-(橙紅色)、CrO42-(黃色)等形式存在, CrO42-和Cr2O72-在溶液中可相互轉化2CrO42-+2H+![]() Cr2O72-+H2O。 室溫下,初始濃度為1.0mol/L的Na2CrO4溶液中c(Cr2O72-)隨c(H+)的變化如圖所示,回答下列問題:
Cr2O72-+H2O。 室溫下,初始濃度為1.0mol/L的Na2CrO4溶液中c(Cr2O72-)隨c(H+)的變化如圖所示,回答下列問題:

(1)由圖可知,隨著溶液酸性增強,CrO42-的平衡轉化率__________(填“增大“減小”或“不變”)。根據A(1.0,0.25)點數據,計算出該轉化反應的平衡常數為__________。
(2)升高溫度,溶液中CrO42-的平衡轉化率減小,則該反應的ΔH_______0(填“大于”“小于”或“等于”)。
(3) 在化學分析中采用K2CrO4為指示劑,以AgNO3標準溶液滴定溶液中的Cl-,利用Ag+與CrO42-生成磚紅色沉淀,指示到達滴定終點。當溶液中Cl-恰好完全沉淀(濃度等于1.0×10-5mol/L)時,溶液中c(Ag+)為_______ mol/L,此時溶液中c(CrO42-)等于__________ mol/L。 (已知Ag2CrO4、AgCl的Ksp分別為2.0×10-12和2.0×10-10)。
【答案】增大 1.0×1014 小于 2.0×10-5 5.0×10-3
【解析】
(1)根據圖示中c(H+)與c(Cr2O72-)的關系分析;A點時溶液的c(H+)=1×10-7mol/L,Cr2O72-的濃度為0.25mol/L,結合反應方程式及平衡常數的含義計算K值大小;
(2)根據升高溫度,化學平衡向吸熱反應方向移動分析;
(3)依據Ksp(AgCl)=c(Ag+)·c(Cl-)及c(Cl-)=1.0×10-5mol/L計算c(Ag+),然后根據Ksp(Ag2CrO4)= c2(Ag+)·c(CrO42-)再進行計算c(CrO42-)。
(1)由圖可知,隨著溶液的酸性增強,c(Cr2O72-)的濃度增大,故鉻酸根離子的平衡轉化率增大;
A點時溶液的c(H+)=1×10-7mol/L,c(Cr2O72-)=0.25mol/L,則消耗的CrO42-的濃度為0.5mol/L,則溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,此時該轉化反應的平衡常數為K=![]() =
=![]() =1.0×1014;
=1.0×1014;
(2)根據平衡移動原理:升高溫度,化學平衡向吸熱反應方向移動。由于升高溫度后CrO42-的平衡轉化率減小,說明平衡向逆反應方向移動,則逆反應為吸熱反應,因此該反應的正反應為放熱反應,所以△H<0;
(3)當溶液中Cl-完全沉淀時,即c(Cl-)=1.0×10-5mol/L,依據Ksp(AgCl)=2.0×10-10,計算得到c(Ag+)=![]() =
=![]() =2.0×10-5mol/L;此時溶液中c(CrO42-)=
=2.0×10-5mol/L;此時溶液中c(CrO42-)=![]() =5.0×10-3mol/L。
=5.0×10-3mol/L。


科目:高中化學 來源: 題型:
【題目】下列有關敘述不正確的是( )
A. 在K37ClO3+6H35Cl(濃)=KCl+3Cl2↑+3H2O反應中,若有212克氯氣生成,則反應中電子轉移的數目為5NA
B. 常溫下,向等濃度、等體積的Na2CO3和NaHCO3溶液中滴加等量的酚酞溶液,碳酸鈉溶液中紅色更深,證明陰離子水解常數Kh: CO32->HCO3-
C. 含0.2molH2SO4的濃硫酸與足量Zn完全反應,轉移的電子數目可能為0.3NA
D. 標準狀況下,33.6L Cl2與足量CH4在光照條件下充分反應,生成的C-Cl鍵數目為3.0NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是部分短周期元素的常見化合價與原子序數的關系圖:

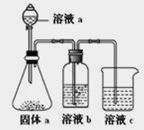
(1)元素B在周期表中的位置___________________________________。
(2)用電子式表示D2G的形成過程_______________________________________________________,其所含化學鍵類型為_____________。
(3)C2-、D+、G2-離子半徑由大到小順序是________________________(用離子符號回答)。
(4)某同學設計上圖實驗證明A、F的非金屬性強弱關系。
①若溶液a為濃鹽酸,固體a為石灰石,溶液 b和c分別為____________________,____________________。
②溶液c中的離子方程式為_______________________________________。
③請從原子結構的角度解釋非金屬性A>F的原因:________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列實驗和現象,所得實驗結論正確的是( )
選項 | 實驗 | 現象 | 實驗結論 |
A | 向某溶液中先滴加適量稀硝酸,再滴加少量BaCl2溶液 | 出現白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一種或幾種 |
B | 向裝有Fe(NO3)2溶液的試管中加入稀硫酸 | 在管口觀察到紅棕色氣體 | HNO3分解成了NO2 |
C |
| 左邊棉球變為橙色,右邊棉球變為藍色 | 氧化性:Cl2>Br2>I2 |
D | SO2和SO3混合氣體通入Ba(NO3)2溶液 | 出現白色沉淀 | 得到的沉淀只有BaSO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為測定某有機化合物A的結構,進行如下實驗:
Ⅰ.分子式的確定:
(1)將有機物A置于氧氣流中充分燃燒,實驗測得生成7.2gH2O和13.2gCO2,消耗氧氣10.08L(標準狀況),則該物質中各元素的原子個數之比是____________________。
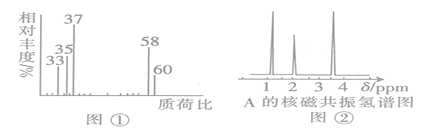
(2)用質譜儀測定該有機化合物的相對分子質量,得到如圖①所示質譜圖,則其相對分子質量為________,該物質的分子式是_______________。
(3)根據價鍵理論,預測A可能的結構簡式: _________________________。
Ⅱ.結構式的確定:
(4)核磁共振氫譜能對有機物分子中不同位置的氫原子給出不同的峰值(信號),根據峰值可以確定分子中氫原子的種類和數目。經測定,有機物A的核磁共振氫譜如圖②,則A的結構簡式為___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹽MN溶于水存在如圖過程,下列有關說法中不正確的是

A. 該過程可表示MN的水解過程
B. 相同條件下結合H+的能力N->OH-
C. 該過程使溶液中的c(OH-)>c(H+)
D. 溶液中存在c(HN)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲胺(CH3NH2)是一種一元弱堿,其電離方程式為:CH3NH2 + H2O ![]() CH3NH3+ + OH-。常溫下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀鹽酸,混合溶液的pH與相關微粒濃度的關系如圖所示。下列說法中錯誤的是
CH3NH3+ + OH-。常溫下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀鹽酸,混合溶液的pH與相關微粒濃度的關系如圖所示。下列說法中錯誤的是
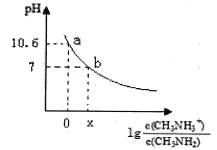
A. b點對應加入鹽酸的體積V<20.00mL
B. 常溫下,根據a點可知甲胺的電離平衡常數Kb=10 -3.4
C. b點可能存在關系:c(Cl-) > c(CH3NH3+) > c(H+) = c(OH-)
D. V=20.00mL時,溶液呈弱酸性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學用語中,正確的是( )
A. 次氯酸的結構式:H—O—Cl
B. 氮氣的電子式:∶N∶∶∶N∶
C. CO2分子的電子式:O=C=O
D. 用電子式表示氯化氫分子的形成過程:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應式:mX(g)+nY(?)![]() pQ(s)+2mZ(g),已知反應已達平衡,此時c(X)=0.3mol/L,其他條件不變,若容器縮小到原來的
pQ(s)+2mZ(g),已知反應已達平衡,此時c(X)=0.3mol/L,其他條件不變,若容器縮小到原來的![]() ,c(X)=0.5mol/L,下列說法正確的是( )
,c(X)=0.5mol/L,下列說法正確的是( )
A.反應向逆方向移動B.Y可能是固體或液體
C.系數n>mD.Z的體積分數減小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com