
現有幾種弱電解質的電離度(25℃,0.1mol?L-1)如下表:
|


科目:高中化學 來源: 題型:閱讀理解
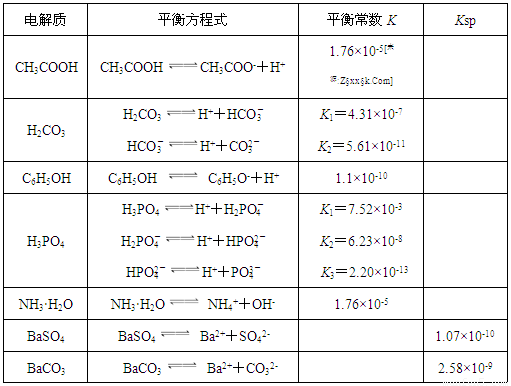
| 電解質 | 平衡方程式 | 平衡常數K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- |
K1=4.31×10-7 K2=5.61×10-11 |
|
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
|
| NH3?H2O | NH3?H2O?NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4?Ba2++SO42- | 1.07×10-10 | |
| BaCO3 | BaCO3?Ba2++CO32- | 2.58×10-9 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
下表是幾種弱電解質的電離平衡常數、難溶電解質的溶度積Ksp (25℃)。
回答下列問題:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,則它們酸性由強到弱的順序為 (須填編號);
(2)寫出C6H5OH與Na3PO4反應的離子方程式: ;
(3)25℃時,將等體積等濃度的醋酸和氨水混合,混合液中:c(CH3COO-)
c(NH4+);(填“>”、“=”或“<”)
(4)25℃時,向10ml 0.01mol/L苯酚溶液中滴加Vml0.01mol/L氨水,混合溶液中粒子濃度關系正確的是 ;
A.若混合液pH>7,則V≥10
B.若混合液pH<7,則c((NH4+)>c (C6H5O-) >c(H+)>c (OH-)
C.V=10時,混合液中水的電離程度小于10ml0.01mol/L苯酚溶液中水的電離程度
D.V=5時,2c(NH3·H2O)+2 c (NH4+)= c (C6H5O-)+c (C6H5OH)
(5)水解反應是典型的可逆反應.水解反應的化學平衡常數稱為水解常數(用Kh表示),類比化學平衡常數的定義,請寫出Na2CO3第一步水解反應的水解常數的表達式 。
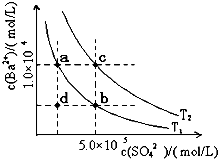
(6)Ⅰ.如下圖所示,有T1、T2兩種溫度下兩條BaSO4在水中的沉淀溶解平衡曲線,回答下列問題:
① T1 T2(填>、=、<),
T2溫度時Ksp(BaSO4)= ;
② 討論T1溫度時BaSO4的沉淀溶解平衡曲線,下列說法正確的是
A.加入Na2SO4可使溶液由a點變為b點
B.在T1曲線上方區域(不含曲線)任意一點時,均有BaSO4沉淀生成
C.蒸發溶劑可能使溶液由d點變為曲線上a、b之間的某一點(不含a、b)
D.升溫可使溶液由b點變為d點
Ⅱ.現有0.2mol的BaSO4沉淀,每次用1L飽和Na2CO3溶液(濃度為1.7mol/L)處理。若使BaSO4中的SO42-全部轉化到溶液中,需要反復處理 次。[提示: BaSO4(s)+ CO32- (aq) BaCO3(s)+ SO42- (aq) ]
查看答案和解析>>
科目:高中化學 來源:2011-2012學年浙江省臺州市高三上學期期末質量評估化學試卷 題型:填空題
下表是幾種弱電解質的電離平衡常數、難溶電解質的溶度積Ksp (25℃)。
回答下列問題:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,則它們酸性由強到弱的順序為 (須填編號);
(2)寫出C6H5OH與Na3PO4反應的離子方程式: ;
(3)25℃時,將等體積等濃度的醋酸和氨水混合,混合液中:c(CH3COO-)
c(NH4+);(填“>”、“=”或“<”)
(4)25℃時,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子濃度關系正確的是 ;
A.若混合液pH>7,則V≥10
B.若混合液pH<7,則c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10時,混合液中水的電離程度小于10ml 0.01mol/L苯酚溶液中水的電離程度
D.V=5時,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O-)+ c (C6H5OH)
(5)水解反應是典型的可逆反應.水解反應的化學平衡常數稱為水解常數(用Kh表示),類比化學平衡常數的定義,請寫出Na2CO3第一步水解反應的水解常數的表達式 。
(6)Ⅰ.如下圖所示,有T1、T2兩種溫度下兩條BaSO4在水中的沉淀溶解平衡曲線,回答下列問題:
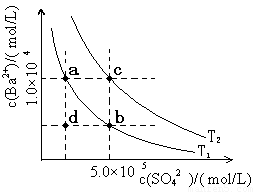
① T1 T2(填>、=、<),
T2溫度時Ksp(BaSO4)= ;
② 討論T1溫度時BaSO4的沉淀溶解平衡曲線,下列說法正確的是
A.加入Na2SO4可使溶液由a點變為b點
B.在T1曲線上方區域(不含曲線)任意一點時,均有BaSO4沉淀生成
C.蒸發溶劑可能使溶液由d點變為曲線上a、b之間的某一點(不含a、b)
D.升溫可使溶液由b點變為d點
Ⅱ.現有0.2mol的BaSO4沉淀,每次用1L飽和Na2CO3溶液(濃度為1.7mol/L)處理。若使BaSO4中的SO42-全部轉化到溶液中,需要反復處理 次。[提示: BaSO4(s)+ CO32- (aq) BaCO3(s)+ SO42- (aq) ]
BaCO3(s)+ SO42- (aq) ]
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| 弱電解質 | α/% | 弱電解質 | α/% |
| CH3COOH | 1.3 | NH3?H2O | 1.3 |
| HF | 7.8 | HCN | 0.0079 |
| A.①CH3COOH②HF③HCN,三種一元酸的酸性由強到弱的順序是③>②>① |
| B.相同物質的量濃度的①CH3COONa ②NaF③NaCN的pH大小順序是①>②>③ |
| C.向NaF溶液中加入鹽酸,[Na+]不變,[H+]增大,[OH-]和[F-]減小 |
| D.NaF溶液中各種離子的濃度由大到小的順序是[Na+]>[F-]>[OH-]>[H+] |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com