
【題目】利用下列實驗裝置完成相應的實驗,能達到實驗目的的是( )
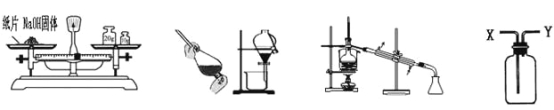
A. 稱量NaOH固體 B. 用酒精提取溴水中的溴 C. 除去水中的氯化鈉 D. 從Y進氣收集CO2
科目:高中化學 來源: 題型:
【題目】工業上硫化堿法制備Na2S2O2的原理是2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(該反應的△H<0),某研究小組在實驗室用此法制備Na2S2O2的裝置與步驟如下,請回答有關問題:
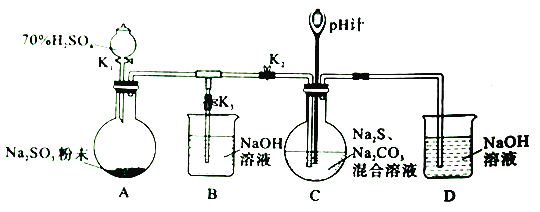
I、制備Na2S2O2實驗步驟如下:
步驟1:先組裝儀器,然后________。
步驟2:添加藥品。關閉K1、K2、K3按圖中所示依固體、溶液順序將所需藥品加入各儀器。
步驟3:打開K2,關閉K3,調節K1,使硫酸緩慢勻速滴下,導管口有氣泡冒出,pH計讀數逐漸減小。當pH計讀數接近7時,打開K3,關閉K1、K2。
步驟4:將C中所得溶液加熱濃縮,冷卻析出Na2S2O2,經過濾、洗滌、干燥,得到產品。
(1)步驟1中缺少的操作是___________。
(2)裝置A中發生反應的化學方程式為___________。
(3)為了使SO2盡可能被吸收完全,在不改變裝置C中溶液濃度、體積的條件下,除了及時攪拌反應物外,還可以采取的措施有________(任寫一條)。
(4)裝置C中Na2S和Na2CO3的物質的量濃度之比約為2:1,若Na2S過量則C中會出現淡黃色的渾濁,用離子方程式解釋其原因為____________。
(5)實驗制得的Na2S2O3產品中可能含有Na2SO3、Na2SO4等雜質。請設計實驗,檢測Na2S2O3產品中是否存在Na2SO4雜質,簡要說明實驗操作、現象和結論_____________。
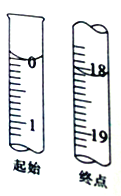
II.測定產品純度
準確稱取Wg產品,用適量蒸餾水溶解,以淀粉作指示劑,用濃度為0.1000mol/L碘的標準溶液滴定。反應原理為2S2O32-+I2=S4O62-+2I-
(6)滴定至終點時的現象為____________。
(7)滴定起始和終點的液面位置如圖,則消耗碘的標準溶液體積為______mL,計算所得樣品的純度為_________(用含W的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】油脂(成分假設全部為硬脂酸甘油酯)經皂化反應后,反應所得的硬脂酸鈉在水里形成的分散系屬于( )
A. 溶液 B. 乳濁液
C. 懸濁液 D. 膠體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】連二亞硫酸鈉(Na2S2O4)俗稱保險粉,是一種強還原劑。工業常用惰性電極電解亞硫酸氫鈉的方法制備連二亞硫酸鈉,原理裝置如圖所示,下列說法正確的是

A. b電極應該接電源的負極
B. 裝置中所用離子交換膜為陰離子交換膜
C. 電路中每轉移1mole-消耗SO2的體積為11.2L
D. a電極的電極反應式為:2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在______ molAl2(SO4)3中含0.3 mol SO42–,含Al3+約_______________個。
(2)同溫同壓下,相同質量的SO2氣體和SO3氣體,其分子數之比為_________,密度之比為_________。
(3)質量同為46 g的兩種氣體,NO2和N2O4,物質的量之比為________,二者所含O原子個數之比為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】酚酞含片是一種治療消化系統疾病的藥物,其有效成分的結構簡式如圖所示。
下列對該有效成分的說法正確的是
A. 所有原子可能共平面
B. 核磁共振氫譜中有7個峰
C. 能發生加聚反應生成高分子化合物
D. 1 mol該物質最多能與含2 molNaOH的燒堿溶液反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用石油產品A(C3H6)為主要原料,合成具有廣泛用途的有機玻璃PMMA。流程如下(部分產物和條件省略)
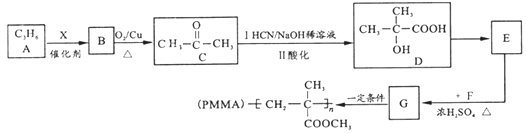
試回答下列問題:
(1)B的名稱________;X試劑為_______(化學式);D中官能團名稱_________。
(2)E→G的化學方程式為________________________________________,反應類型是_________。
(3)T是G的同分異構體,1molT與足量新制Cu(OH)2懸濁液反應最多生成2molCu2O沉淀,T的結構有________種(不含立體結構)。
(4)若高分子化合物PMMA的相對分子質量為1.5×106,其聚合度為_______。
(5)參照上述流程,以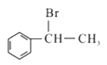 為原料合成
為原料合成 (其它原料自選)。設計合成路線:________________________。
(其它原料自選)。設計合成路線:________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年科學家提出“綠色自由”構想。把含有大量CO2的空氣吹入K2CO3溶液中,再把CO2從溶液中提取出來,并使之與H2反應生成可再生能源甲醇。其工藝流程如圖所示:
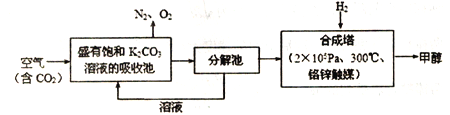
(1) 已知:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-94.9kJ/mol
CH3OH(g) ΔH1=-94.9kJ/mol
CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
則在合成塔中,CO2與H2反應生成氣態的H2O和甲醇的熱化學方程式為_________.
(2)該工藝在哪些方面體現了“綠色自由”構想中的“綠色”( 寫出一條即可)________.
(3)一定條件下,往2L 恒容密閉容器中充入1mol CO2 和3 mol H2,在不同催化劑作用下發生反應I、反應Ⅱ與反應Ⅲ,相同時間內CO2的轉化率隨溫度變化如下圖所示:

①催化劑效果最佳的反應是__________(填“反應I”,“反應Ⅱ”,“反應Ⅲ”)。
②b點v (正)______ v (逆)(填“>”, “<”, “=”)。
③若此反應在a點時已達平衡狀態,a點的轉化率比c點高的原因是_________。
④c點時該反應的平衡常數K =________。
(4)科學家還研究了其它轉化溫室氣體的方法,利用下圖所示裝置可以將CO2轉化為氣體燃料CO。該裝置工作時,N電極的電極反應式為__________。
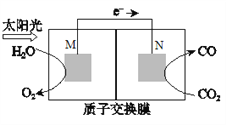
(5)CO2在自然界循環時可與CaCO3反應,CaCO3是一種難溶物質,其Ksp=2.8×10-9。CaCl2溶液與Na2CO3溶液混合可形成CaCO3沉淀,現將等體積的CaCl2溶液與Na2CO3溶液混合,若Na2CO3溶液的濃度為5.6×10-5mo/L,則生成沉淀所 需CaCl2溶液的最小濃度為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用質量分數98%、密度為1.84g·cm-3的濃硫酸配制480mL0.92mol·L-1的稀硫酸
(1)配制時,除量筒、燒杯、玻璃棒外還需玻璃儀器有________、________。
(2)減小誤差量取時需選用合適的量筒量取____________mL濃硫酸
(3)在容量瓶的使用方法中,下列操作不正確的是________。
A.使用容量瓶前檢查它是否漏水
B.容量瓶用蒸餾水洗凈后,再用待配溶液潤洗
C.配制溶液時,如果試樣是固體,把稱好的試樣用紙條小心倒入容量瓶中,緩慢加入蒸餾水到接近標線1~2cm處,改用膠頭滴管加蒸餾水到標線
D.往容量瓶中轉移溶液時應用玻璃棒引流
(4)在配制過程中,其他操作都是正確的,下列操作會引起誤差偏高的是__________。
①轉移溶液時不慎有少量灑到容量瓶外面 ②沒有洗滌燒杯和玻璃棒③定容時俯視刻度線④容量瓶不干燥,含有少量蒸餾水⑤定容后塞上瓶塞反復搖勻,靜置后,液面低于刻度線,再加水至刻度線。⑥未冷卻到室溫就將溶液轉移到容量瓶并定容
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com