
【題目】甲醇既是基本有機化工原料,又可作為燃料用于替代礦物燃料。
(1)工業(yè)上合成甲醇的反應為:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列數(shù)據(jù)是該反應在不同溫度下的化學平衡常數(shù)(K)。
CH3OH(g) ΔH。下表所列數(shù)據(jù)是該反應在不同溫度下的化學平衡常數(shù)(K)。
溫度 | 250℃ | 300℃ | 350℃ |
平衡常數(shù)K | 2.041 | 0.270 | 0.012 |
由表中數(shù)據(jù)判斷該反應為 ________反應(填“吸熱”或“放熱”)。 某溫度下,將2 molCO和6 molH2充入2 L的密閉容器中充分反應,達到平衡后,測得c(CO)=0.2 mol/L,則CO的轉化率為______,此時的溫度為______(從表中選擇)。
(2)已知在常溫常壓下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
則反應CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)現(xiàn)以甲醇燃料電池,采用電解法來處理酸性含鉻廢水(主要含有Cr2O72)時,實驗室利用如圖裝置模擬該法:

①N電極的電極反應式為 ___________________________________。
②請完成電解池中Cr2O72轉化為Cr3+的離子反應方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)處理廢水時,最后Cr3+以Cr(OH)3形式除去,當c(Cr3+)=1×105 mol/L時,Cr3+沉淀完全,此時溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)
【答案】放熱 80% 250℃ ![]() 或
或![]() (ΔH1-ΔH2)+2ΔH3 O2+4e+4H+=2H2O 6 14H+ 2 6 7H2O 5.6
(ΔH1-ΔH2)+2ΔH3 O2+4e+4H+=2H2O 6 14H+ 2 6 7H2O 5.6
【解析】
(1)由表中數(shù)據(jù)可知,隨溫度升高平衡常數(shù)減小,說明升高溫度平衡逆向移動,則正反應為放熱反應;
某溫度下,將2molCO和6molH2充入2L的密閉容器中,充分反應,達到平衡后,測得c(CO)=0.2mol/L,則:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始濃度(mol/L): 1 3 0
變化濃度(mol/L): 0.8 1.6 0.8
平衡濃度(mol/L): 0.2 1.4 0.8
由此計算CO轉化率和此溫度下平衡常數(shù),進而判斷溫度;
(2)利用蓋斯定律構造目標熱化學方程式并求焓變;
(3)①氫離子由質子交換膜由M電極區(qū)移向N電極區(qū),則M為負極、N為正極,負極上發(fā)生氧化反應,甲醇失去電子,生成二氧化碳與氫離子,正極發(fā)生還原反應,氧氣獲得電子,與通過質子交換膜的氫離子結合為水;
②電解池溶液里Cr2O72-轉化為Cr3+,化合價降低共6價,左側Fe電極為陽極,Fe失去電子生成Fe2+,酸性條件Fe2+將Cr2O72-還原為Cr3+,自身被氧化為Fe3+,化合價升高共1價,化合價升降最小公倍數(shù)為6,則Cr2O72-的系數(shù)為1,Fe2+的系數(shù)為6,再結合電荷守恒、原子守恒配平方程式;
(4)Ksp=c(Cr3+)×c3(OH-)=6.4×1031計算c(OH-),根據(jù)KW=c(H+)×c(OH-)計算溶液中c(H+),再根據(jù)pH=-lgc(H+)計算。
(1)由表中數(shù)據(jù)可知,隨溫度升高平衡常數(shù)減小,說明升高溫度平衡逆向移動,則正反應為放熱反應,故△H<0,某溫度下,將2molCO和6molH2充入2L的密閉容器中,充分反應,達到平衡后,測得c(CO)=0.2mol/L,則:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始濃度(mol/L): 1 3 0
變化濃度(mol/L): 0.8 1.6 0.8
平衡濃度(mol/L): 0.2 1.4 0.8
CO轉化率=![]() ×100%=80%,平衡常數(shù)K=
×100%=80%,平衡常數(shù)K=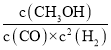 =
=![]() =2.041,故溫度為250℃,
=2.041,故溫度為250℃,
故答案為:放熱;80%;250℃;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
根據(jù)蓋斯定律![]() (①②+4×③)可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=
(①②+4×③)可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H= ![]() 或
或![]() (ΔH1-ΔH2)+2ΔH3;
(ΔH1-ΔH2)+2ΔH3;
(3)①氫離子由質子交換膜由M電極區(qū)移向N電極區(qū),則M為負極、N為正極,負極上發(fā)生氧化反應,甲醇失去電子,生成二氧化碳與氫離子,負極電極反應式為:CH3OH6e+H2O=6H++CO2↑,正極發(fā)生還原反應,氧氣獲得電子,與通過質子交換膜的氫離子結合為水,正極電極反應式為:O2+4e+4H+=2H2O,
故答案為:O2+4e+4H+=2H2O;
②電解池溶液里Cr2O72-轉化為Cr3+,化合價降低共6價,左側Fe電極為陽極,Fe失去電子生成Fe2+,酸性條件Fe2+將Cr2O72-還原為Cr3+,自身被氧化為Fe3+,化合價升高共1價,化合價升降最小公倍數(shù)為6,則Cr2O72-的系數(shù)為1,Fe2+的系數(shù)為6,反應離子方程式為:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案為:6;14H+;2;6;7H2O;
(4)Ksp=c(Cr3+)×c3(OH)=6.4×10-31,c(Cr3+)=1×10-5mol·L1時,溶液中c(OH)=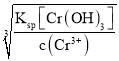 =
=![]() =4×10-9mol·L1,則c(H+)=
=4×10-9mol·L1,則c(H+)=![]() =
=![]() mol/L=2.5×10-6mol·L1,則pH=lg(2.5×10-6) =5.6。
mol/L=2.5×10-6mol·L1,則pH=lg(2.5×10-6) =5.6。


 海淀課時新作業(yè)金榜卷系列答案
海淀課時新作業(yè)金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 輕松課堂標準練系列答案
輕松課堂標準練系列答案科目:高中化學 來源: 題型:
【題目】某同學在實驗室中進行如圖所示實驗。
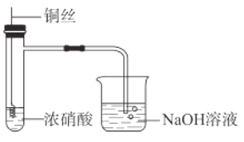
(1)銅絲與濃硝酸發(fā)生反應的離子方程式是________。
(2)燒杯中NaOH溶液的作用是________。
(3)銅絲下端彎成螺旋狀的原因是________。
(4)根據(jù)反應產(chǎn)生的現(xiàn)象,從不同角度推斷該反應所屬反應類型:
①根據(jù)________現(xiàn)象,可推斷該反應為氧化還原反應。
②根據(jù)反應后試管壁發(fā)熱的現(xiàn)象,可推斷該反應屬于________反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著科技進步和人類環(huán)保意識的增強,如何利用CO2已經(jīng)成為世界各國特別關注的問題。
已知:CO2與CH4經(jīng)催化重整制得合成氣:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
(1)降低溫度,該反應速率會_______________(填“增大”或“減小”);一定壓強下,由最穩(wěn)定單質生1 mol化合物的焓變?yōu)樵撐镔|的摩爾生成焓。已知CO2(g)、CH4(g)、CO(g)的摩爾生成焓分別為-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。則上述重整反應的ΔH=____________kJ/mol。
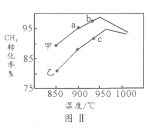
(2)T1℃時,在兩個相同剛性密閉容器中充入CH4和CO2分壓均為20 kPa,加入催化劑Ni/α-Al2O3并分別在T1℃和T2℃進行反應,測得CH4轉化率隨時間變化如圖Ⅰ所示。
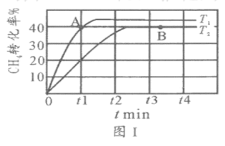
①A點處v正_______B點處(填“<”、“>”或“=”)
②研究表明CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A點處v生成(CO)=__________mol·g-1·s-1。
(3)上述反應達到平衡后,若改變某一條件,下列變化能說明平衡一定正向移動的是________________(填代號)。
A.正反應速率增大 B.生成物的百分含量增大 C.平衡常數(shù)K增大
(4)其他條件相同,在甲、乙兩種不同催化劑作用下,相同時間內測得CH4轉化率與溫度變化關系如圖Ⅱ,C點___________________(填“可能”、“一定”或“一定未”)達到平衡狀態(tài),理由是_____________;CH4的轉化率b點高于a點的可能原因是_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】新型鋰-空氣電池具有能量密度高的優(yōu)點,有希望成為新能源汽車的電源,其結構如圖所示,下列說法正確的是( )

A.電子從金屬鋰流出通過外電路流向石墨烯,固體電解質允許通過水
B.放電時,正極反應式:O2+4e-+4H+=2H2O
C.應用該電池電鍍銅,陰極質量增加64g,理論上將消耗11.2LO2
D.若把水性電解液換成固體氧化物電解質,則易引起正極材料碳孔堵塞
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列熱化學方程式中,正確的是( )
A.甲烷的燃燒熱為890.3kJ·mol-1,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ/mol
B.500℃、30MPa下,將0.5molN2(g)和1.5molH2(g)置于密閉容器中充分反應生成NH3(g)放熱19.3kJ,其熱化學方程式為:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ/mol
2NH3(g) △H=-38.6kJ/mol
C.已知乙醇和乙烯的燃燒熱分別為1366.8kJ·mol-1和1411.0kJ·mol-1,則乙烯水化制乙醇的熱化學方程式為:CH2=CH2(g)+H2O(l)=C2H5OH(l) ΔH=-44.2kJ·mol-1
D.HCl和NaOH反應的中和熱△H=-57.3kJ/mol,則H2SO4和Ca(OH)2反應的中和熱△H=2×(-57.3kJ/mol)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質檢驗的實驗操作、現(xiàn)象及結論均正確的是( )
選項 | 實驗操作及現(xiàn)象 | 實驗結論 |
A | 向某溶液中加入鹽酸酸化的氯化鋇溶液,有白色沉淀生成 | 該溶液中一定含有SO |
B | 向某溶液中加入2滴KSCN溶液,溶液不顯紅色.再向溶液中加入幾滴新制的氯水,溶液變?yōu)榧t色 | 該溶液中一定含有Fe2+ |
C | 將某氣體通入品紅溶液中,品紅溶液褪色 | 該氣體一定為SO2 |
D | 向某溶液中加入氫氧化鈉溶液并加熱,產(chǎn)生有刺激性氣味氣體,該氣體能使?jié)駶櫟乃{色石蕊試紙變紅 | 該溶液中一定含有NH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在一個2L的密閉容器中,X、Y、Z三種物質的物質的量隨時間的變化曲線如圖所示.根據(jù)圖中數(shù)據(jù)填空:

(1)反應開始至2min,以氣體Z表示的平均反應速率為_________.
(2)該反應的化學方程式為_________.
(3)若X、Y、Z均為氣體,2min后反應達到平衡,反應達平衡時:此時體系的壓強是開始時的_________倍;達平衡時,容器內混合氣體的平均相對分子質量比起始投料時_________(填"增大""減小"或"相等").
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CuCl 是難溶于水的白色固體,是一種重要的催化劑。工業(yè)上,由孔雀石(主要成分Cu(OH)2·CuCO3, 含FeS、FeO 和SiO2雜質)制備CuCl 的某流程如下

下列說法不正確的是
A.H2O2將溶液1 中Fe2+氧化為Fe3+,再通過控制pH 轉化為Fe(OH)3除去
B.CO32-作用是控制溶液pH,促使CuCl 沉淀的生成
C.SO32-將溶液3 中的Cu2+還原,反應得到CuCl
D.若改變試劑加入順序,將溶液3 緩慢加入到含大量SO32-/CO32-的溶液中,同樣可制取CuCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從樟科植物枝葉提取的精油中含有下列甲、乙兩種成分:
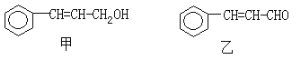
(1)乙中所含官能團的名稱為____________________。
(2)由甲轉化為乙需經(jīng)下列過程(已略去各步反應的無關產(chǎn)物,下同):
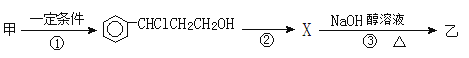
設計步驟①的目的是_________________________,反應②的化學方程式為_________________(注明反應條件)。
(3)欲檢驗乙中的含氧官能團,選用下列的一種試劑是_______________(填序號)。
A.溴水 B.酸性高錳酸鉀溶液 C.溴的CCl4溶液 D.銀氨溶液
(4)乙經(jīng)氫化和氧化得到丙(![]() )。寫出同時符合①能發(fā)生銀鏡反應;②能與FeCl3溶液發(fā)生顯色反應;③核磁共振氫譜圖上產(chǎn)生4個吸收峰等要求的丙的同分異構體結構簡式_______________、________________。
)。寫出同時符合①能發(fā)生銀鏡反應;②能與FeCl3溶液發(fā)生顯色反應;③核磁共振氫譜圖上產(chǎn)生4個吸收峰等要求的丙的同分異構體結構簡式_______________、________________。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com