
【題目】已知乙醛(CH3CHO)和新制氫氧化銅的反應如下:
CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
某實驗小組做上述反應時,發現NaOH的用量對反應產物有影響,于是他們采用控制變量的方法,均使用0.5 mL 40%的乙醛溶液進行下列實驗。
編號 | 2%CuSO4溶液的體積 | 10%NaOH溶液的體積 | 振蕩后 | pH | 加乙醛水浴加熱后的沉淀顏色 |
1 | 2 mL | 3滴 | 淺藍綠色沉淀 | 5~6 | 淺藍綠色沉淀 |
2 | a | 15滴 | 淺藍色沉淀 | 7~8 | 黑色沉淀 |
3 | 1 mL | 1 mL | 藍色懸濁沉淀較少 | 9~10 | 紅褐色沉淀 |
4 | b | 2 mL | 藍色懸濁沉淀較多 | 11~12 | 紅色沉淀 |
5 | 1 mL | 3 mL | 藍紫色溶液 | 12~13 | ———— |
(1)上表中a、b應為 (填字母序號)。
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查閱資料可知,實驗1中的淺藍綠色沉淀主要成份為Cu2(OH)2SO4,受熱不易分解。寫出生成Cu2(OH)2SO4反應的化學方程式 。基于實驗1、2的現象可以得出結論:NaOH用量較少時, 。
(3)小組同學推測實驗3中的紅褐色沉淀可能是CuO和Cu2O的混合物,其理論依據是 。
(4)為了進一步證明實驗4中紅色沉淀的成分,該小組同學查閱資料得知:Cu2O在堿性條件下穩定,在酸性溶液中可轉化為Cu2+、Cu。并進行了以下實驗。
ⅰ.將實驗4反應后的試管靜置,用膠頭滴管吸出上層清液。
ⅱ.向下層濁液中加入過量稀硫酸,充分振蕩、加熱,應觀察到的現象是 。
(5)小組同學繼續查閱資料得知:Cu(OH)2可與OH-繼續反應生成藍紫色溶液([Cu(OH)4] 2-),由此提出問題:[Cu(OH)4] 2-能否與乙醛發生反應,生成紅色沉淀?設計實驗解決這一問題,合理的實驗步驟是 。基于上述實驗,該小組同學獲得結論:乙醛參與反應生成紅色沉淀時,需控制體系的pH>10。
【答案】(1)B (2)2NaOH + 2CuSO4 = Cu2(OH)2SO4↓ + Na2SO4
乙醛未參與氧化反應,(或是含銅元素的化合物在發生變化)
(3)此題答案可從“現象”或“理論”兩個角度提出依據
依據現象提出依據:實驗2中的黑色沉淀可能是CuO;實驗4中的紅色沉淀可能是Cu2O,所以實驗3中的紅褐色沉淀,可能是CuO和Cu2O的混合物。
依據理論提出依據:當NaOH用量逐漸增多時,產生的Cu(OH)2一部分受熱分解生成黑色的CuO;另一部 分被乙醛還原為Cu2O紅色沉淀,所以實驗3中的紅褐色沉淀,可能是CuO和Cu2O的混合物。
(4)溶液變為藍色,有紅色固體
(5)將1 mL 2%CuSO4溶液與3 mL(或>3 mL)10%NaOH溶液混合振蕩后(或取實驗5的藍紫色溶液),加入0.5 mL 40%的乙醛溶液,水浴加熱
【解析】試題分析:(1)為控制變量,中a、b應為2 mL,1 mL;(2)生成Cu2(OH)2SO4反應的化學方程式2NaOH + 2CuSO4 = Cu2(OH)2SO4↓ + Na2SO4 。基于實驗1、2的現象可以得出結論:NaOH用量較少時,含銅元素的化合物在發生變化;(3)當NaOH用量逐漸增多時,產生的Cu(OH)2一部分受熱分解生成黑色的CuO;另一部分被乙醛還原為Cu2O紅色沉淀,所以實驗3中的紅褐色沉淀,可能是CuO和Cu2O的混合物;(4)Cu2O在堿性條件下穩定,在酸性溶液中可轉化為Cu2+、Cu,向下層濁液中加入過量稀硫酸,充分振蕩、加熱,應觀察到的現象是溶液變為藍色,有紅色固體;(5) [Cu(OH)4] 2-能否與乙醛發生反應,生成紅色沉淀?實驗解決這一問題,合理的實驗步驟是,將1 mL 2%CuSO4溶液與3 mL(或>3 mL)10%NaOH溶液混合振蕩后(或取實驗5的藍紫色溶液),加入0.5 mL 40%的乙醛溶液,水浴加熱。基于上述實驗,該小組同學獲得結論:乙醛參與反應生成紅色沉淀時,需控制體系的pH>10。


 名師伴你成長課時同步學練測系列答案
名師伴你成長課時同步學練測系列答案科目:高中化學 來源: 題型:
【題目】(1)氨氣具有還原性,在銅的催化作用下, 氨氣和氟氣發生反應生成A和B。A為銨鹽,B在標準狀況下為氣態。在此反應中,若有1體積氨氣參加反應,則有0.75體積氟氣參加反應;若有8.96 L氨氣(標準狀況)參加反應,則生成0.3 mol A。在標準狀況下,生成2.24 L B,則該反應中轉移電子的物質的量為 mol。
(2)將等物質的量Fe2O3與FeCl3置于密閉管中加熱,能恰好完全反應,且只生成一種產物X,其物質的量是反應物總物質的量的1.5倍,寫出X的化學式 ;
(3)完成以下氧化還原反應的離子方程式:
( )MnO4-+ SO32-+ = Mn2++ SO42-+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知一定溫度和壓強下,合成氨反應:N2(g)+3H2(g) ![]() 2NH3(g);△H=-92.0KJ·mol-1將1mol N2和3mol H2充入一密閉容器中,保持恒溫恒壓,在催化劑存在時進行反應,達到平衡時,測得N2的轉化率為20%。若在相同條件下,起始時在該容器中充入2mol NH3,s反應達到平衡時的熱量變化是
2NH3(g);△H=-92.0KJ·mol-1將1mol N2和3mol H2充入一密閉容器中,保持恒溫恒壓,在催化劑存在時進行反應,達到平衡時,測得N2的轉化率為20%。若在相同條件下,起始時在該容器中充入2mol NH3,s反應達到平衡時的熱量變化是
A.吸收18.4KJ熱量
B.放出18.4KJ熱量
C.吸收73.6KJ熱量
D.放出73.6KJ熱量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有如下溶液:
①1.0mL0.10molL-1雙氧水
②1.0mL0.20molL-1雙氧水
③3.0mL0.10molL-1KMnO4溶液
④3.0mL0.010molL-1KMnO4溶液。
所有實驗均需加入1.0mL稀硫酸(足量),依據褪色時間長短判定反應速率快慢:
(1)寫出發生反應的離子方程式_________________________;若某反應的化學方程式為2KMnO4+9H2O2+3H2SO4=K2SO4+2MnSO4+7O2↑+12H2O,則該反應的氧化劑為______________,若有9molH2O2參加該反應,則反應轉移電子數目為___________;
(2)某溫度下,若要探究反應物濃度對反應速率的影響,則應選擇試劑______進行實驗(填序號)。
(3)某溫度下,某同學按照(2)中選擇試劑進行實驗,褪色時間為5s:
①計算以H2O2表示的反應速率為___________;
②進行實驗過程中,該同學發現顏色變化會出現先慢后快并突然褪色的現象。為此該同學又進行了一次平行實驗,只是加入少量MnSO4固體,結果溶液立即褪色,請推測顏色變化會出現先慢后快并突然褪色的現象的原因___________;
(4)某同學在不同溫度下,分別取兩份等體積不同濃度的雙氧水與等量KMnO4溶液進行反應,繪制出c(H2O2)隨時間(t)變化的曲線如圖所示,若A、B分別為不同溫度時測定的曲線,則_____(填“A”或“B”)曲線所對應的實驗溫度高,判斷的依據是___________;
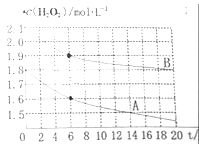
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關燃料的說法錯誤的是( )
A.燃料燃燒產物CO2是溫室氣體之一
B.化石燃料完全燃燒不會造成大氣污染
C.以液化石油氣代替燃油可減少大氣污染
D.燃料不完全燃燒排放的CO是大氣污染物之一
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《漢書》中“高奴縣有洧水可燃”,沈括在《夢溪筆談》對從地表滲出的、當地人稱為“石脂”或“洧水”的使用有“予知其煙可用,試掃其煙為墨,黑光如漆,松果不及也,此物必大行于世”的描述, 關于上文的下列說法中正確的是 ( )
A. “洧水”的主要成分是油脂 B. “洧水”的主要成分是煤油
C. “洧水”的主要成分是石油 D. 其煙的主要成分是石墨
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】COCl2的分解反應為COCl2(g)![]() Cl2(g)+CO(g)。將一定量COCl2(g)和Cl2(g)放入一密閉容器中,2min時達到平衡后,各物質的物質的量在不同條件下的變化情況如下圖所示。
Cl2(g)+CO(g)。將一定量COCl2(g)和Cl2(g)放入一密閉容器中,2min時達到平衡后,各物質的物質的量在不同條件下的變化情況如下圖所示。

下列相關說法中不正確的是
A.1min時以CO表示的逆反應速率小于3min時以CO表示的正反應速率
B.若在6min時改變的條件為升高溫度,則反應的平衡常數K增大
C.12min時改變的條件可為減小CO的濃度,16min時改變的條件可為增大反應容器的體積
D.以CO表示在4~5min、10~11min和12~13min時平均反應速率為v(4~5)<v(10~11)<v(12~13)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.某興趣小組利用下圖裝置測定某硫酸工廠排放尾氣中二氧化硫的含量,圖中氣體流量計B用于準確測量通過的尾氣體積。將尾氣通入一定體積已知濃度的碘水中測定SO2的含量。當洗氣瓶C中溶液藍色消失時,立即關閉活塞A。
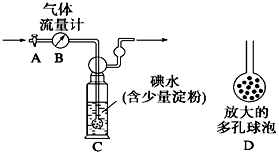
⑴ C中導管末端連接一個多孔球泡D,可以提高實驗的準確度,其理由是 。
⑵ C中發生反應的離子方程式 。
⑶ C中溶液藍色消失后,沒有及時關閉活塞A,測得的SO2含量 (填“偏高”、“偏低”或“無影響”)。
II.實驗室常用Na2SO3固體與濃硫酸反應制取SO2 :
⑷ 現有已制得SO2的飽和溶液,請利用此溶液(其他試劑任選),設計一個簡單實驗,比較SO2與Fe2+ 還原性的強弱(要求:寫出實驗步驟、現象和結論) 。
⑸ 某研究小組測定部分變質的Na2SO3固體樣品中Na2SO3的含量:
① 取a克Na2SO3固體樣品配制成100mL溶液,取10.00mL該溶液于錐形瓶中,加入幾滴淀粉溶液作指示劑,0.0100mol/L碘水進行滴定,滴定終點現象為 ,記錄數據,重復滴定2次,平均消耗碘水20.00mL。
② 計算:樣品中亞硫酸鈉的質量分數為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com