
(14分)在稀硫酸中,KMnO4和H2O2能發生氧化還原反應:
氧化反應:H2O2-2e-===2H++O2↑
還原反應:MnO+5e-+8H+===Mn2++4H2O
(1)寫出該氧化還原反應的離子方程式:______________________________________。
(2)該反應中氧化劑是________,被氧化的元素是________;若有0.5 mol H2O2參加此反應,則轉移電子個數為________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反應的化學方程式為__________________;這時若有0.5 mol H2O2發生分解,則轉移電子個數為________。
(1)5H2O2+2MnO4+6H+=2Mn2++5O2↑+8H2O (2)KMnO4 氧(O) 6.02×1023
(3)2H2O2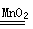 2H2O+O2↑
3.01×1023
2H2O+O2↑
3.01×1023
【解析】(1)根據電子的得失守恒可知,氧化反應和還原反應合并后的方程式為
5H2O2+2MnO4+6H+=2Mn2++5O2↑+8H2O。
(2)氧化劑得到電子,被還原,發生還原反應,所以氧化劑是KMnO4;失去電子,化合價升高的是還原劑,所以被氧化的元素是氧;根據方程式可知,氧元素的化合價從-1價升高到0價,所以1molH2O2在反應中失去2個電子,因此轉移電子是6.02×1023。
(3)H2O2分解生成氧氣和水,方程式為2H2O2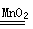 2H2O+O2↑;在反應中H2O2既是氧化劑,也是還原劑,轉移1個電子,所以反應中轉移的電子數是3.01×1023。
2H2O+O2↑;在反應中H2O2既是氧化劑,也是還原劑,轉移1個電子,所以反應中轉移的電子數是3.01×1023。


 開心快樂假期作業暑假作業西安出版社系列答案
開心快樂假期作業暑假作業西安出版社系列答案 名題訓練系列答案
名題訓練系列答案科目:高中化學 來源: 題型:
| 濃硫酸 |
| △ |
| 濃硫酸 |
| △ |




| 催化劑 |
| △ |
 +(n-1)H2O
+(n-1)H2O
| 催化劑 |
| △ |
 +(n-1)H2O
+(n-1)H2O 、
、 、
、
 、
、 、
、


查看答案和解析>>
科目:高中化學 來源:2013屆江蘇省興化市板橋高級中學高三9月雙休檢測化學試卷(帶解析) 題型:填空題
(14分)在稀硫酸中,KMnO4和H2O2能發生氧化還原反應:
氧化反應:H2O2-2e-===2H++O2↑
還原反應:MnO+5e-+8H+===Mn2++4H2O
(1)寫出該氧化還原反應的離子方程式:______________________________________。
(2)該反應中氧化劑是________,被氧化的元素是________;若有0.5 mol H2O2參加此反應,則轉移電子個數為________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反應的化學方程式為__________________;這時若有0.5 mol H2O2發生分解,則轉移電子個數為________。
查看答案和解析>>
科目:高中化學 來源:2013屆江蘇省興化市板橋高級中學高三9月雙休檢測化學試卷(帶解析) 題型:填空題
(14分)在稀硫酸中,KMnO4和H2O2能發生氧化還原反應:
氧化反應:H2O2-2e-===2H++O2↑
還原反應:MnO+5e-+8H+===Mn2++4H2O
(1)寫出該氧化還原反應的離子方程式:______________________________________。
(2)該反應中氧化劑是________,被氧化的元素是________;若有0.5 mol H2O2參加此反應,則轉移電子個數為________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反應的化學方程式為__________________;這時若有0.5 mol H2O2發生分解,則轉移電子個數為________。
查看答案和解析>>
科目:高中化學 來源:2010-2011年江蘇泰州中學上學期高三質量檢測化學卷 題型:填空題
(10分)工業上常用廢鐵屑溶于一定濃度的硫酸溶液制備綠礬( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的濃硫酸配制生產用28%的硫酸溶液,則濃硫酸與水的體積比約為1: ▲ 。
(2)為測定某久置于空氣的綠礬樣品中Fe2+的氧化率,某同學設計如下實驗:取一定量的樣品溶于足量的稀硫酸中,然后加入5.00 g鐵粉充分反應,收集到224 mL(標準狀況)氣體,剩余固體質量為3.88 g,測得反應后的溶液中Fe2+的物質的量為0.14 mol(不含Fe3+)。則該樣品中Fe2+離子的氧化率為 ▲ 。
(3)硫酸亞鐵銨[(NH4)2SO4·FeSO4·6H2O](俗稱莫爾鹽),較綠礬穩定,在氧化還原滴定分析中常用來配制Fe2+的標準溶液。現取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液處理,發生反應如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反應后煮沸溶液,趕盡SO2,剩余的KMnO4恰好與V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反應。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范圍為 ▲ ;
②若V=35,試計算混合物中CuS的質量分數。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com