
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(浙江卷參考版) 題型:選擇題
金屬(M)–空氣電池(如圖)具有原料易得、能量密度高等優點,有望成為新能源汽車和移動設備的電源。該類電池放電的總反應方程式為:4M+nO2+2nH2O=4M(OH) n。已知:電池的“理論比能量”指單位質量的電極材料理論上能釋放出的最大電能。下列說法不正確的是

A.采用多孔電極的目的是提高電極與電解質溶液的接觸面積,并有利于氧氣擴散至電極表面
B.比較Mg、Al、Zn三種金屬–空氣電池,Al–空氣電池的理論比能量最高
C.M–空氣電池放電過程的正極反應式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D.在M–空氣電池中,為防止負極區沉積Mg(OH)2,宜采用中性電解質及陽離子交換膜
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(四川卷參考版) 題型:選擇題
向1L含0.01molNaAlO2和0.02molNaOH的溶液中緩慢通入二氧化碳,隨n(CO2)增大,先后發生三個不同的反應,當0.01mol<n(CO2)  0.015時發生的反應是:
0.015時發生的反應是:
2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3。下列對應關系正確的是
選項 | n(CO2)/mol | 溶液中離子的物質的量濃度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(全國3卷參考版) 題型:選擇題
下列有關實驗的操作正確的是
實驗 | 操作 | |
A. | 配制稀硫酸 | 先將濃硫酸加入燒杯中,后倒入蒸餾水 |
B. | 排水法收集KMnO4分解產生的O2 | 先熄滅酒精燈,后移出導管 |
C. | 濃鹽酸與MnO2反應制備純凈Cl2 | 氣體產物先通過濃硫酸,后通過飽和食鹽水 |
D. | CCl4萃取碘水中的I2 | 先從分液漏斗下口放出有機層,后從上口倒出水層 |
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(全國2卷參考版) 題型:簡答題
丙烯腈(CH2=CHCN)是一種重要的化工原料,工業上可用“丙烯氨氧化法”生產,主要副產物有丙烯醛(CH2=CHCHO)和乙腈CH3CN等,回答下列問題:
(1)以丙烯、氨、氧氣為原料,在催化劑存在下生成丙烯腈(C3H3N)和副產物丙烯醛(C3H4O)的熱化學方程式如下:
①C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g) △H=-515kJ/mol
①C3H6(g)+ O2(g)=C3H4O(g)+H2O(g) △H=-353kJ/mol
兩個反應在熱力學上趨勢均很大,其原因是;有利于提高丙烯腈平衡產率的反應條件是;提高丙烯腈反應選擇性的關鍵因素是。
(2)圖(a)為丙烯腈產率與反應溫度的關系曲線,最高產率對應溫度為460OC.低于460OC時,丙烯腈的產率(填“是”或者“不是”)對應溫度下的平衡產率,判斷理由是;高于460OC時,丙烯腈產率降低的可能原因是 (雙選,填標號)
A.催化劑活性降低
B.平衡常數變大
C.副反應增多
D.反應活化能增大
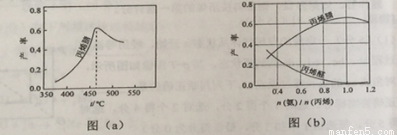
(3)丙烯腈和丙烯醛的產率與n(氨)/n(丙烯)的關系如圖(b)所示。由圖可知,最佳n(氨)/n(丙烯)約為 ,理由是 。進料氨、空氣、丙烯的理論體積約為 。
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(全國1卷參考版) 題型:填空題
[化學——選修3:物質結構與性質]
鍺(Ge)是典型的半導體元素,在電子、材料等領域應用廣泛。回答下列問題:
(1)基態Ge原子的核外電子排布式為[Ar]____________,有__________個未成對電子。
(2)Ge與C是同族元素,C原子之間可以形成雙鍵、叁鍵,但Ge原子之間難以形成雙鍵或叁鍵。從原子結構角度分析,原因是________________。
(3)比較下列鍺鹵化物的熔點和沸點,分析其變化規律及原因_____________________。
GeCl4 | GeBr4 | GeI4 | |
熔點/℃ | ?49.5 | 26 | 146 |
沸點/℃ | 83.1 | 186 | 約400 |
(4)光催化還原CO2制備CH4反應中,帶狀納米Zn2GeO4是該反應的良好催化劑。Zn、Ge、O電負性由大至小的順序是______________。

(5)Ge單晶具有金剛石型結構,其中Ge原子的雜化方式為_______________________,微粒之間存在的作用力是_____________。
(6)晶胞有兩個基本要素:
①原子坐標參數,表示晶胞內部各原子的相對位置,下圖為Ge單晶的晶胞,其中原子坐標參數A為(0,0,0);B為(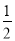 ,0,
,0,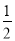 );C為(
);C為(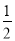 ,
,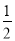 ,0)。則D原子的坐標參數為______。
,0)。則D原子的坐標參數為______。
②晶胞參數,描述晶胞的大小和形狀,已知Ge單晶的晶胞參數a=565.76 pm,其密度為__________g·cm-3(列出計算式即可)。
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(全國1卷參考版) 題型:選擇題
三室式電滲析法處理含Na2SO4廢水的原理如圖所示,采用惰性電極,ab、cd均為離子交換膜,在直流電場的作用下,兩膜中間的Na+和SO42-可通過離子交換膜,而兩端隔室中離子被阻擋不能進入中間隔室。
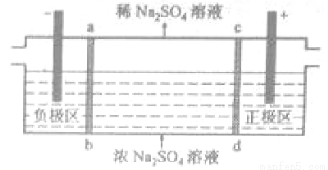
下列敘述正確的是
A.通電后中間隔室的SO42-離子向正極遷移,正極區溶液pH增大
B.該法在處理含Na2SO4廢水時可以得到NaOH和H2SO4產品
C.負極反應為2 H2O–4e–=O2+4H+,負極區溶液pH降低
D.當電路中通過1mol電子的電量時,會有0.5mol的O2生成
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高二下期中化學試卷(解析版) 題型:實驗題
席夫堿類化合物G在催化、藥物、新材料等方面有廣泛應用。合成G的一種路線如下:

已知以下信息:
①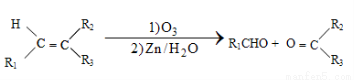
②1molB經上述反應可生成2molC,且C不能發生銀鏡反應。
③D屬于單取代芳香烴,其相對分子質量為106。
④核磁共振氫譜顯示F苯環上有兩種化學環境的氫。
⑤
回答下列問題:
(1)由A生成B的化學方程式為 ,反應類型為 。
(2)D的化學名稱是 ,由D生成E的化學方程式為: 。
(3)G的結構簡式為 。
(4)F的同分異構體中含有苯環的有多種(不考慮立體異構)。其中核磁共振氫譜中有4組峰,且面積比為6:2:2:1的是_____ __。(寫出其中的一種的結構簡式)。
(5)由苯和化合物C經如下步驟可合成N-異丙基苯胺。
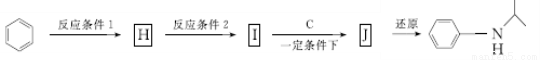
反應條件1所選擇的試劑為____ ________;反應條件2所選擇的試劑為___ _____;I的結構簡式為____ _________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年浙江省溫州市十校聯合高二下期中化學試卷(解析版) 題型:選擇題
某化合物的分子式是C5H11Cl,實驗結果表明:分子中有2個—CH3、2個—CH2—、1個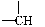 和1個—Cl,它的結構有幾種(不考慮對映異構現象)( )
和1個—Cl,它的結構有幾種(不考慮對映異構現象)( )
A.2 B.3 C.4 D.5
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com