
| A. | ③④ | B. | ③ | C. | ①③ | D. | ②④ |
分析 氯化銀懸濁液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),即沉淀電離為離子的速率與離子結合成沉淀的速率相等,該過程為可逆過程,據此進行解答.
解答 解:①AgCl(s)?Ag+(aq)+Cl-(aq)為AgCl的沉淀溶解平衡,不是電離方程式,AgCl在熔融狀態下完全電離,為強電解質,故①錯誤;
②該反應為AgCl的沉淀溶解平衡,不是電離方程式,根據該平衡不能判斷AgCl為強電解質,故②錯誤;
③AgCl(s)?Ag+(aq)+Cl-(aq)為可逆反應,說明Cl-與Ag+的反應不能完全進行到底,故③正確;
④AgCl(s)?Ag+(aq)+Cl-(aq)為可逆過程,所以Ag+與Cl-的反應不能完全進行到底,故④錯誤;
故選B.
點評 本題考查了沉淀溶解平衡的應用,題目難度不大,注意對沉淀溶解平衡方程式的理解,明確難溶物溶解平衡及其沉淀轉化的本質為解答關鍵,試題側重基礎知識的考查,培養了學生的靈活應用能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
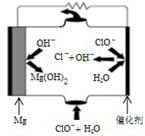 利用所學知識回答下列問題
利用所學知識回答下列問題| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 1.0×10-7 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常溫下不能自發進行,說明△H<0 | |
| B. | 用惰性電極電解1L1mol/L的CuSO4溶液,當陰極析出3.2 g銅時,加入0.05 molCu(OH)2固體可將溶液恢復至原濃度 | |
| C. | 已知25℃時,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl溶解度大于Ag2CrO4溶解度 | |
| D. | 25℃時,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固體,該溶液中水的電離程度將增大,且Kw不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
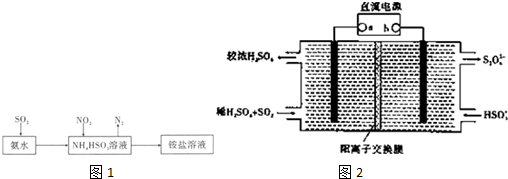
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶度積就是溶解平衡時難溶電解質在溶液中的各離子濃度的乘積 | |
| B. | 溶度積常數是不受任何條件影響的常數,簡稱溶度積 | |
| C. | 可用離子積Qc與溶度積Ksp的比較來判斷沉淀溶解平衡進行的方向 | |
| D. | 所有物質的溶度積都是隨溫度的升高而增大的 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com