
分析 令氨氣為700L,則水為1L,根據n=$\frac{V}{{V}_{m}}$計算氨氣的物質的量,根據m=nM計算氨氣的質量,根據m=ρV計算水的質量,進而計算溶液的質量,根據V=$\frac{m}{ρ}$計算溶液的體積,再根據c=$\frac{n}{V}$計算溶液的物質的量濃度.
解答 解:令氨氣為700L,則水為1L,
氨氣的物質的量=$\frac{700L}{22.4L/mol}$=$\frac{700}{22.4}$mol,氨氣的質量=$\frac{700}{22.4}$mol×17g/mol=$\frac{17×700}{22.4}$g,
水的質量=1L×1000g/L=1000g,
溶液的體積=$\frac{\frac{17×700}{22.4}g+1000g}{892g/L}$=$\frac{22400+17×700}{22.4×892}$L,
所得氨水的物質的量濃度=$\frac{\frac{700}{22.4}mol}{\frac{22400+17×700}{22.4×892}L}$=18.27mol/L,
答:此氨水溶液的物質的量濃度為18.27mol/L.
點評 本題考查物質的量濃度計算,難度不大,側重對物質的量濃度定義考查.


 王后雄學案教材完全解讀系列答案
王后雄學案教材完全解讀系列答案 海淀課時新作業金榜卷系列答案
海淀課時新作業金榜卷系列答案科目:高中化學 來源: 題型:解答題
| 元素編號 | 元素性質或原子結構 |
| T | 失去一個電子后,形成Ne原子電子層結構 |
| X | 最外層電子數是次外層電子數的2倍 |
| Y | 其單質之一是空氣中主要成分,最常見的助燃劑 |
| Z | 形成雙原子單質分子,黃綠色氣體 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 液態HCl不導電,因此HCl是非電解質 | |
| B. | Na2O熔融態時能導電,所以Na2O是電解質 | |
| C. | 液態的銅導電性很好,所以銅是電解質 | |
| D. | CO2水溶液能導電,所以CO2是電解質. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe→Fe2O3→Fe(OH)3 | B. | SO2→SO3→H2SO4 | ||
| C. | FeCl2→Fe(OH)2→Fe(OH)3 | D. | NO→NO2→HON3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 放電時,鋰為負極,發生還原反應 | |
| B. | 充電時陽極反應式為:8Li2S-16e-═S8+16Li+ | |
| C. | 電解質可采用導電有機電解質 | |
| D. | 鋰硫電池的理論電壓為2.0V,則單位質量的單質硫的比能量為3.35 kW•h/kg |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol | B. | 1.33 mol | C. | 2 mol | D. | 3 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
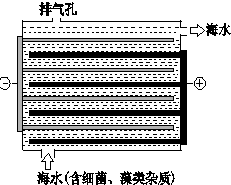 海洋化學資源的研究和合理利用具有廣闊前景,從海水中可提取氯、溴、碘等鹵族元素.
海洋化學資源的研究和合理利用具有廣闊前景,從海水中可提取氯、溴、碘等鹵族元素.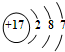 ,碘在元素周期表中的位置是第五周期ⅦA族,HI的穩定性比HBr弱(填寫“強”或“弱”).
,碘在元素周期表中的位置是第五周期ⅦA族,HI的穩定性比HBr弱(填寫“強”或“弱”).| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com