
分析 (1)[Fe(CO)5]中鐵原子與CO形成配位鍵;Fe的原子核外電子數為26,根據能量最低原理書寫價電子排布式;
(2)原子數目相等、價電子總數也相等的微粒互為等電子體,等電子體的結構相似;
(3)碳原子采取sp3雜化,則分子中C原子雜化軌道數目為4,雜化軌道數目=σ鍵數+孤電子對數;CH3OH分子之間形成氫鍵,熔沸點高于甲烷的;
(4)CH3CHO分子中C原子均沒有孤對電子,-CH3中的碳原子雜化軌道數目為4、-CHO中的碳原子雜化軌道數目為3.
解答 解:(1)[Fe(CO)5]中鐵原子與CO形成配位鍵,Fe元素化合價為0價,Fe的原子核外電子數為26,基態電子排布式為[Ar]3d64s2,價電子排布式為:3d64s2,
故答案為:0;3d64s2;
(2)原子數目相等、價電子總數也相等的微粒互為等電子體,與CO互為等電子體的分子、離子分別為N2、CN-,
等電子體的結構相似,則CO與氮氣分子結構相似,結構式為C≡O,該分子中含1個σ鍵、2個π鍵,.
故答案為:N2;CN-;C≡O;1;2;
(3)在CH4、CO、CH3OH三種物質中甲烷、甲醇中C原子雜化軌道數目為4,碳原子采取sp3雜化,CH3OH分子之間形成氫鍵,且為極性分子,則熔沸點高于甲烷的,
故答案為:CH4、CH3OH;CH3OH分子之間形成氫鍵,且為極性分子;
(4)CH3CHO分子中C原子均沒有孤對電子,-CH3中的碳原子雜化軌道數目為4、-CHO中的碳原子雜化軌道數目為3,分別采取sp3雜化、sp2雜化,
故答案為:sp3;sp2.
點評 本題是對物質結構與性質的考查,涉及核外電子排布、等電子體、化學鍵、分子結構與性質、雜化方式判斷等,注意氫鍵對物質性質的影響.


 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 兩者都是酸性氧化物,故均不與酸反應 | |
| B. | 兩者都可以與NaOH溶液反應 | |
| C. | CO2 的溶沸點比SiO2高 | |
| D. | 兩者都能與水反應生成對應的酸且碳酸的酸性大于硅酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
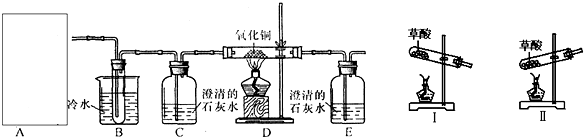
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S2-、Cl-、K+ | B. | Cl-、Br-、I- | C. | Na+、Mg2+、Cl- | D. | O2-、Mg2+、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 砹是一種有色固體,它的氣態氫化物很不穩定 | |
| B. | 元素周期表有7個主族,7個副族,1個0族,1個Ⅷ族,共16縱行 | |
| C. | 銣的硫酸鹽易溶解于水,其氫氧化物一定是強堿 | |
| D. | 氯化氫比溴化氫穩定,HClO4酸性強于HBrO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
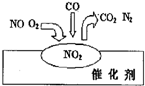
| A. | NO2是該過程的最終產物 | |
| B. | NO和O2必須在催化劑表面才能反應 | |
| C. | 汽車尾氣的主要污染成分是CO2和NO | |
| D. | 該催化轉化的總反應方程式為:2NO+O2+4CO$\frac{\underline{\;催化劑\;}}{\;}$ 4CO2+N2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 2015年10月5日,中國著名藥學家屠呦呦獲得諾貝爾獎生理學或醫學獎,獲獎理由是“因為發現青蒿素-一種用于治療瘧疾的藥物,挽救了全球特別是發展中國家的數百萬人的生命”.從植物黃花蒿莖 葉中提取的,其結構簡式如圖,下列說法不正確的是( )
2015年10月5日,中國著名藥學家屠呦呦獲得諾貝爾獎生理學或醫學獎,獲獎理由是“因為發現青蒿素-一種用于治療瘧疾的藥物,挽救了全球特別是發展中國家的數百萬人的生命”.從植物黃花蒿莖 葉中提取的,其結構簡式如圖,下列說法不正確的是( )| A. | 它的分子式為C15H2205 | |
| B. | 青蒿素易發生加成反應和氧化反應 | |
| C. | 青蒿素在堿性條件下易發生水解反應 | |
| D. | 它在常見有機溶劑中的溶解度大于在水中的溶解度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗室用大理石和稀鹽酸制取CO2:2H++CO32-═CO2↑+H2O | |
| B. | 銅和稀硝酸反應:Cu+2H+═H2↑+Cu2+ | |
| C. | 向AlCl3溶液中加入過量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | NaHCO3溶液與NaOH溶液反應:OH-+HCO3-═CO32-+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 充電時MgxMo3S4只發生還原反應 | |
| B. | 放電時Mo3S4只發生氧化反應 | |
| C. | 充電時陽極反應式為 Mo3S42x--2xe-=Mo3S4 | |
| D. | 放電時負極反應式為xMg=xMg2+-2xe- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com