
【題目】A與B反應生成C,假定反應由A、B開始,它們的初始濃度均為1.0mol·L-1。反應進行2min后A的濃度為0.8 mol·L-1,B的濃度為0.6 mol·L-1,C的濃度為0.6 mol·L-1。
⑴2min內的平均速率為V(A)=_________,V(B)=________,V(C)=________;
⑵V(A):V(B):V(C)=___________________;
⑶該反應的化學方程式為:_______________________________________。
【答案】0.1mol·L-1·min-1 0.2 mol·L-1·min-1 0.3 mol·L-1·min-1 1:2:3 A+2B=3C
【解析】
據v=![]() 計算v(A)、v(B)、v(C),速率之比等于其化學計量數之比,進而確定化學計量數,書寫化學方程式。
計算v(A)、v(B)、v(C),速率之比等于其化學計量數之比,進而確定化學計量數,書寫化學方程式。
(1)v(A)=![]() =
=![]() =0.1mol/(Lmin),v(B)=
=0.1mol/(Lmin),v(B)=![]() =
=![]() =0.2mol/(Lmin),v(C)=
=0.2mol/(Lmin),v(C)=![]() =
=![]() =0.3mol/(Lmin);
=0.3mol/(Lmin);
(2)ν(A):ν(B):ν(C)=0.1mol/(Lmin):0.2mol/(Lmin):0.3mol/(Lmin)=1:2:3;
(3)由速率之比等于其化學計量數之比可知反應方程式為:A+2B=3C。


科目:高中化學 來源: 題型:
【題目】直接排放含SO2的煙氣會形成酸雨,危害環境。工業上常采用催化還原法和堿吸收法處理SO2氣體。
(1)下圖所示:1mol CH4完全燃燒生成氣態水的能量變化和1mol S(g)燃燒的能量變化。

在催化劑作用下,CH4可以還原SO2生成單質S(g)、H2O(g)和CO2,寫出該反應的熱化學方程式________________________________________________________。
(2)焦炭催化還原二氧化硫的化學方程式為2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定壓強下,向1L密閉容器中充入足量的焦炭和1molSO2發生反應,測得SO2的生成速率與S2(g)的生成速率隨溫度變化的關系如圖所示:
S2(g)+2CO2(g)。一定壓強下,向1L密閉容器中充入足量的焦炭和1molSO2發生反應,測得SO2的生成速率與S2(g)的生成速率隨溫度變化的關系如圖所示:
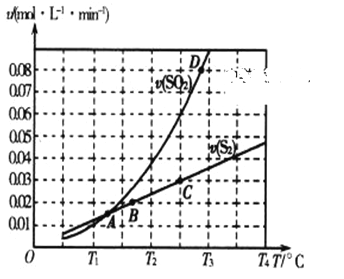
①A、B、C、D四點對應的狀態中,達到平衡狀態的有_____________(填字母)。
②該反應的△H_____0(填“>”“<”或“=”)。
③下列措施能夠增大SO2平衡轉化率的是______________。
A.降低溫度 B.增加C的量 C.減小容器體積 D.添加高效催化劑
(3)用氨水吸收SO2。25℃時,將含SO2的煙氣通入一定濃度的氨水中,當溶液顯中性時,溶液中的![]() =_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
=_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
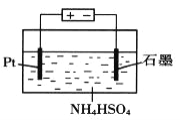
(4)當吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如圖所示裝置電解所得NH4HSO4溶液可制得強氧化劑(NH4)2S2O8,請寫出電解NH4HSO4溶液的化學方程式_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據氧化還原反應:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)設計的原電池如圖所示。請回答下列問題:
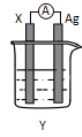
(1)電極X的上發生的電極反應為______反應(氧化或還原);電解質溶液Y是________;
(2)銀電極為電池的_____極,發生的電極反應式為_______;
(3)外電路中的電子__________(填“流出”或“流向”)Ag電極。
(4)當有1.6 g銅溶解時,銀棒增重______ g。
(5)現有如下兩個反應:(A))NaOH+HCl=NaCl+H2O (B)2FeCl3+Fe=3FeCl2
①根據兩反應本質,分別判斷能否用于設計原電池,如果不能,說明其原因_______________。
②如果可以,寫出正極反應式:___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I:運用化學反應原理知識研究如何利用CO、SO2等污染物有非常重要的意義。
(1)用CO可以合成甲醇。
已知: CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H1
CO(g)+1/2O2(g)=CO2(g) △H2
H2(g)+1/2O2(g)=H2O(l) △H3
請寫出由CO和H2形成CH3OH的熱化學方程式___________________________________________
(2)—定壓強下,在容積為2L的密閉容器中充入1mol CO與2mol H2,在催化劑作用下發生反應:
CO(g) +2H2(g)![]() CH3OH(g) △H,CO轉化率與溫度、壓強的關系如圖所示:
CH3OH(g) △H,CO轉化率與溫度、壓強的關系如圖所示:

①下列說法正確的是__________
A.若容器內氣體密度恒定,反應達到平衡狀態
B.若容器內各氣體平均相對分子質量恒定,反應達到平衡狀態
C.若v(CO)=v(CH3OH)時,反應達到平衡狀態
D.反應中,催化劑使平衡向正反應方向移動
②該反應的△H________0,p2_______________p1(填“大于”“小于”或“等于”)。
③100℃時,該反應的化學平衡常數K=__________.

II:甲醇是一種燃料,也可以作為燃料電池的原料
(3)甲醇直接燃燒會產生一定的污染,某實驗小組依據甲醇燃燒的反應原理,設計如圖所示的電池裝置,則電池正極的電極反應式:______,該電池工作時,溶液中的OH-向______極移動,該電池工作一段時間后,測得溶液的pH減小,則該電池總反應的離子方程式為_______________________________________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖裝置(Ⅰ)為一種可充電電池的示意圖,其中的離子交換膜只允許K+通過,該電池放電、充電的化學方程式為2K2S2+KI3![]() K2S4 +3KI。裝置(Ⅱ)為電解池的示意圖,當閉合開關K時,電極X附近溶液先變紅。則閉合K時,下列說法不正確的是( )
K2S4 +3KI。裝置(Ⅱ)為電解池的示意圖,當閉合開關K時,電極X附近溶液先變紅。則閉合K時,下列說法不正確的是( )
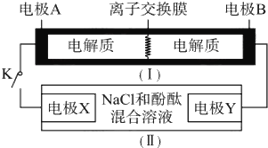
A. K+從左到右通過離子交換膜 B. 電極A上發生的反應為I3-+2e-=3I-
C. 電極Y上發生的反應為2Cl--2e-=Cl2↑ D. 當有0.1 molK+通過離子交換膜,X電極上產生1.12L氣體(標準狀況)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酰氯(NOCl,熔點:-64.5 ℃,沸點:-5.5 ℃)是一種黃色氣體,遇水易水解。可用于合成清潔劑、觸媒劑及中間體等。實驗室可由氯氣與一氧化氮在常溫常壓下合成。
(1)甲組的同學擬制備原料氣NO和Cl2,制備裝置如下圖所示:

為制備純凈干燥的氣體,下表中缺少的藥品是:
裝置Ⅰ | 裝置Ⅱ | ||
燒瓶中 | 分液漏斗中 | ||
制備純凈Cl2 | MnO2 | ①___ | ②___ |
制備純凈NO | Cu | ③___ | ④___ |
(2)乙組同學利用甲組制得的NO和Cl2制備NOCl,裝置如圖所示:

①裝置連接順序為a→________(按氣流自左向右方向,用小寫字母表示)。
②裝置Ⅳ、Ⅴ除可進一步干燥NO、Cl2外,另一個作用是____________。
③裝置Ⅶ的作用是____________。
④裝置Ⅷ中吸收尾氣時,NOCl發生反應的化學方程式為________________。
(3)丙組同學查閱資料,查得王水是濃硝酸與濃鹽酸的混酸,一定條件下該混酸可生成亞硝酰氯和氯氣, 該反應的化學方程式為__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學研究性學習小組的同學在學習了氨的性質后討論:運用類比的思想,既然氨氣具有還原性,能否像H2那樣還原CuO呢?他們設計實驗制取氨氣并探究上述問題。請你參與該小組的活動并完成下列研究:
(一)制取氨氣
(1)寫出實驗制取氨氣的化學方程式_______________________________;
(2)有同學模仿排飽和食鹽水收集氯氣的方法,想用排飽和氯化銨溶液的方法收集氨氣。你認為他能否達到目的?________(填“能”或“否”)。理由是______________________。
(二)該小組中某同學設計了下圖所示的實驗裝置(夾持及尾氣處理裝置未畫出),探究氨氣的還原性:

(1)該裝置在設計上有一定缺陷,為保證實驗結果的準確性,對該裝置的改進措施是:_______________________________________________________________________。
(2)利用改進后的裝置進行實驗,觀察到CuO變為紅色物質,無水CuSO4變藍色,同時生成一種無污染的氣體。寫出氨氣與CuO反應的化學方程式___________________。
(三)問題討論:
有同學認為:NH3與CuO反應生成的紅色物質中可能含有Cu2O。已知:Cu2O是一種堿性氧化物;在酸性溶液中,Cu+的穩定性差(Cu+→Cu+Cu2+)。請你設計一個簡單的實驗檢驗該紅色物質中是否含有Cu2O:______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,橫坐標表示完全燃燒時消耗可燃氣體X(X=A、B、C)的物質的量n(X),縱坐標表示燃燒時生成水的物質的量n(H2O),A、B是兩種可燃氣體,C是A和B的混合氣體,則C的成分及其體積比可能是( )
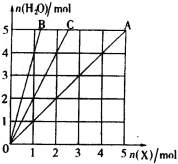
A. C2H4與C3H4 體積比為任意比
B. C2H2與C3H8 體積比1∶2
C. H2與C4H8 體積比2∶1
D. H2與C2H6 體積比3∶1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com