
【題目】A、B、C、D、E是原子序數依次增大的短周期元素,A是短周期中金屬性最強的元素,B是地殼中含量最高的金屬元素,C單質的晶體是良好的半導體材料,D的最外層電子數與內層電子數之比為3:5。
(1)C的原子結構示意圖為 ,D在元素周期表中的位置 。
(2)A單質在氧氣中燃燒生成化合物甲,甲中所含化學鍵為 ;A單質在E單質中燃燒生成化合物乙,乙的電子式為 。
(3)F是中學化學常見元素,它的一種氧化物為紅棕色粉末,B單質與其在高溫條件下反應是冶煉F單質的方法之一,該反應的化學方程式為 。
(4)含B元素的化合物常用作凈水劑,用文字和化學用語解釋凈水原因: 。
(5)E元素的非金屬性強于D元素,用原子結構解釋原因:同周期元素隨著原子序數遞增, ,非金屬性增強。
(6)工業上將干燥的E單質通人D熔融的單質中可制得化合物D2E2,該物質可與水反應生成一種能使品紅溶液褪色的氣體,0.2mol該物質參加反應時轉移0.3mol電子,其中只有一種元素化合價發生改變,該反應的化學方程式為 。
【答案】(1)![]() 第3周期,第VIA族
第3周期,第VIA族
(2)離子鍵、非極性共價鍵![]()
(3)Fe2O3+2Al![]() Al2O3+2Fe
Al2O3+2Fe
(4)Al3++3H2O![]() Al(OH)3+3H+Al3+水解產生氫氧化鋁膠體,能吸附水中懸浮物,使之凝聚達到凈水目的。
Al(OH)3+3H+Al3+水解產生氫氧化鋁膠體,能吸附水中懸浮物,使之凝聚達到凈水目的。
(5)原子半徑遞減,得電子能力增強
(6)2S2Cl2+2H2O =" 3S" +SO2+4HCl
【解析】試題分析:A、B、C、D、E是原子序數依次增大的短周期元素,A是短周期中金屬性最強的元素,則A是鈉元素,B是地殼中含量最高的金屬元素,則B是鋁元素,C單質的晶體是良好的半導體材料,則C為硅元素,D的最外層電子數與內層電子數之比為3:5,則D為硫元素,E為氯元素,F是中學化學常見元素,它的一種氧化物為紅棕色粉末,B單質與其在高溫條件下反應是冶煉F單質的方法之一,該反應為鋁熱反應,則F為鐵元素。
(1)C為硅元素,C的原子結構示意圖為![]() ,D為硫元素,D在元素周期表中的位置是第3周期,第VIA族。
,D為硫元素,D在元素周期表中的位置是第3周期,第VIA族。
(2)鈉單質在氧氣中燃燒生成化合物甲為過氧化鈉,甲中所含化學鍵為離子鍵、非極性共價鍵;鈉單質在氯氣中燃燒生成化合物乙為氯化鈉,氯化鈉的電子式為![]() 。
。
(3)鋁單質與氧化鐵在高溫條件下反應是冶煉鐵的方法之一,該反應的化學方程式為Fe2O3+2Al![]() Al2O3+2Fe。
Al2O3+2Fe。
(4)B是鋁元素,含B元素的化合物常用作凈水劑,因為Al3++3H2O![]() Al(OH)3+3H+,Al3+水解產生氫氧化鋁膠體,能吸附水中懸浮物,使之凝聚達到凈水目的。
Al(OH)3+3H+,Al3+水解產生氫氧化鋁膠體,能吸附水中懸浮物,使之凝聚達到凈水目的。
(5)氯元素的非金屬性強于硫元素,用原子結構解釋原因:同周期元素隨著原子序數的遞增,原子半徑遞減,得電子能力增強,非金屬性增強。
(6)工業上將干燥的E單質通人D熔融的單質中可制得化合物為S2Cl2,該物質可與水反應生成一種能使品紅溶液褪色的氣體為SO2,0.2mol該物質參加反應時轉移0.3mol電子,則1molS2Cl2參加反應要轉移1.5mol電子,其中只有一種元素化合價發生改變,則應為硫元素的化合價在改變,該反應的化學方程式為2S2Cl2+2H2O =" 3S" +SO2+4HCl。


科目:高中化學 來源: 題型:
【題目】已知反應①:CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反應②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反應②:H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的溫度下的平衡常數分別為K1和K2,該溫度下反應③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的溫度下的平衡常數分別為K1和K2,該溫度下反應③:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常數為K.則下列說法正確的是
CO2(g)+H2(g)的平衡常數為K.則下列說法正確的是
A.反應①的平衡常數K1=[c(CO2)c(Cu)]/[c(CO)c(CuO)]
B.對于反應③,恒容時,溫度升高,H2的濃度減小,則該反應的焓變為正值
C.反應③的平衡常數K=K1/K2
D.對于反應③,恒溫恒容下,增大壓強,H2的濃度一定減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Y元素最高正價與最低負價的絕對值之差是4;Y元素與M元素形成離子化合物,并在水中電離出電子層結構相同的離子,該化合物是( )
A.KCl
B.Na2S
C.Na2O
D.K2S
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】正鹽A能發生下圖所示的反應,圖中①~⑧分別代表有關反應中的一種物質(某些物質已略去),其中①、②、④、⑤為無色氣體,⑥為紅棕色氣體。
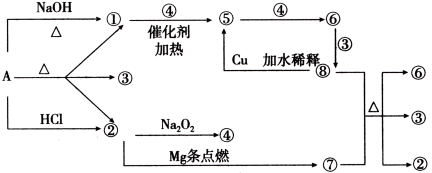
請完成下列各題:
(1)寫出化學式A ,⑥ ,⑦ ;
(2)寫出下列反應化學方程式:
⑧+⑦→②+③+⑥: ;①+④→⑤: ;
(3)⑧→⑤的離子方程式為: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是工業電解飽和食鹽水的裝置示意圖,下列說法中不正確的是

A.裝置出口①處的物質是氯氣
B.出口②處的物質是氫氣,該離子交換膜只能讓陽離子通過
C.裝置中發生的反應的離子方程式2Cl﹣+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
D.該裝置是將電能轉化為化學能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】大氣中SO2含量的增加會造成“酸雨”。下列活動會導致大氣中SO2含量增加的是
A.燃燒煤炭中加入石灰石 B.利用風力、水力發電
C.硫酸工廠尾氣回收處理 D.節假日燃放煙花爆竹
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反應中:
(1)氧化劑是(填化學式) ,還原劑是(填化學式) 。
(2)在該反應中,若消耗了15.8g KMnO4,則轉移了 mol 電子。
(3)用雙線橋表示高錳酸鉀和濃鹽酸反應的電子轉移方向和數目。
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于金屬的說法不正確的是
A.金屬一般具有導電性、導熱性、延展性
B.鐵在潮濕的空氣中不會生銹
C.鋁表面有氧化物保護膜
D.金屬鈉保存在煤油中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NH4Al(SO4)2是食品加工中最為快捷的食品添加劑,用于焙烤食品中;NH4HSO4在分析試劑、醫藥、電子工業中用途廣泛,請回答下列問題:

(1)相同條件下,pH相同的NH4Al(SO4)2中c(NH4+)_____________(填“=”、“>” 或“<”)NH4HSO4中c(NH4+)。
(2)如圖1是0.1 molL﹣1電解質溶液的pH隨溫度變化的圖象。
①其中符合0.1 molL﹣1 NH4Al(SO4)2的pH隨溫度變化的曲線是___________(填寫字母);
②室溫時,0.1 molL﹣1 NH4Al(SO4)2中2c(SO42-)﹣c(NH4+)﹣3c(Al3+)=_________molL﹣1(填數值)
(3)室溫時,向100 mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到的溶液pH與NaOH溶液體積的關系曲線如圖2所示。試分析圖中a、b、c、d四個點,水的電離程度最大的是_____________;在c點,溶液中各離子濃度由大到小的排列順序是_______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com