
| A. | 金屬鈉投入到足量的稀鹽酸中:Na+2H+=Na++H2↑ | |
| B. | CuO溶解在稀鹽酸中:O-+2H+=H2O | |
| C. | 氫氧化鋇溶液與稀硫酸反應:Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| D. | 碳酸氫鈣溶液與稀鹽酸反應:HCO3-+H+=H2O+CO2↑ |
分析 A.電荷不守恒;
B.氧化物化學式應保留;
C.離子個數配比不符合物質結構;
D.二者反應生成氯化鈣、水、二氧化碳.
解答 解:A.金屬鈉投入到足量的稀鹽酸中,離子方程式:2Na+2H+=2Na++H2↑,故A錯誤;
B.CuO溶解在稀鹽酸中,離子方程式:CuO+2H+=H2O=Cu2+,故B錯誤;
C.氫氧化鋇溶液與稀硫酸反應,離子方程式:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O,故C錯誤;
D.碳酸氫鈣溶液與稀鹽酸反應,離子方程式:HCO3-+H+=H2O+CO2↑,故D正確;
故選:D.
點評 本題考查了離子方程式的書寫,明確相關物質的性質及發生反應的實質是解題關鍵,注意離子反應遵循客觀事實、遵循原子個數、電荷守恒規律,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | ②③ | B. | ①②③④ | C. | ③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省徐州市高一上第一次月考化學卷(解析版) 題型:選擇題
某溶液中可能含有下列6種離子中的某幾種:Cl—、SO42— 、CO32—、NH4+、Na+、K+。為確認溶液組成進行如下實驗:(1)200mL上述溶液,加入足量BaCl2溶液,反應后將沉淀過濾、洗滌、干燥,得沉淀4.30g,向沉淀中加入過量的鹽酸,有2.33g沉淀不溶。(2)向(1)的濾液中加入足量的NaOH溶液,加熱,產生能促使濕潤紅色石蕊試紙變藍的氣體1.12L(已換算成標準狀況,假定產生的氣體全部逸出)。由此可以得出關于原溶液組成的正確結論是
、CO32—、NH4+、Na+、K+。為確認溶液組成進行如下實驗:(1)200mL上述溶液,加入足量BaCl2溶液,反應后將沉淀過濾、洗滌、干燥,得沉淀4.30g,向沉淀中加入過量的鹽酸,有2.33g沉淀不溶。(2)向(1)的濾液中加入足量的NaOH溶液,加熱,產生能促使濕潤紅色石蕊試紙變藍的氣體1.12L(已換算成標準狀況,假定產生的氣體全部逸出)。由此可以得出關于原溶液組成的正確結論是
A.一定存在SO42—、CO32—、NH4+,可能存在Cl—、Na+、K+
B.一定存在Cl—、SO42—、CO32—、NH4+,一定不存在Na+、K+
C.原溶液中c(CO32—)=0.01mol·L-1
D.如果上述6種離子都存在,則c(Cl—)>c(SO42—)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省徐州市高一上第一次月考化學卷(解析版) 題型:選擇題
14C的放射性可用于考古斷代。下列關于14C的說法中正確的是
A. 質量數為6 B. 質子數為6 C. 電子數為14 D. 中子數為14
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 青銅是我國使用最早的合金材料,目前世界上使用量最大的合金材料是鋁合金 | |
| B. | 碳酸鈉俗名純堿,也叫蘇打,可用于清洗廚房用具的油污 | |
| C. | 鋼鐵生銹、沙里淘金、蒸餾法制取純凈水都涉及了化學變化 | |
| D. | 工業酒精既可以用作燃料制“乙醇汽油”,又可以勾兌成白酒飲用 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 周期表中第15縱行(從左往右數)元素的最高正價為+5 | |
| B. | 元素周期表中位于金屬和非金屬非界線附近的元素屬于過渡元素 | |
| C. | 離子化合物中可能含有共價鍵,共價化合物中可能含有離子鍵 | |
| D. | 同一主族的甲乙兩種元素,甲的原子序數為a,則乙的原子序數可能為a+4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣是一種黃綠色有毒氣體,密度比空氣大 | |
| B. | 氯氣常用于制備漂白粉等殺菌消毒劑 | |
| C. | 新制氯水具有漂白作用,是因為Cl2具有強氧化性 | |
| D. | 氯元素在自然界中以化合態存在 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化碳的結構式:O-C-O | |
| B. | 原子核內有10個中子的氧原子:${\;}_{8}^{18}$O | |
| C. | F原子結構示意圖: | |
| D. | N2的電子式: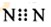 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com