
【題目】向50mLNa2SO4和Na2CO3的混合溶液中加入過量的BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中再加入過量的稀HCl,充分反應后,沉淀減少到4.66g,并有氣體產生。
(1)寫出有關離子方程式 。
(2)原混合物溶液中Na2SO4和Na2CO3的物質的量濃度各是多少?
(3)產生的氣體在標準狀況下的體積是多少升?
【答案】(1)Ba2++SO42-=BaSO4↓、Ba2++ CO32-= BaCO3↓、BaCO3+2H+= Ba 2++CO2↑+H2O;(2)c(Na2SO4)=0.4mol/L、c(Na2CO3)=1mol/L;(3)1.12L
【解析】試題分析:本題考查離子方程式的書寫,物質的量在化學方程式計算中的應用。
(1)Na2SO4和Na2CO3的混合溶液中加入過量的BaCl2溶液發生反應的離子方程式為:Ba2++SO42-=BaSO4↓、Ba2++ CO32-= BaCO3↓。得到的白色沉淀為BaSO4和BaCO3的混合物,加入過量稀HCl,只有BaCO3溶解,反應的離子方程式為BaCO3+2H+= Ba 2++CO2↑+H2O。
(2)加入過量稀HCl后得到的4.66g沉淀為BaSO4,n(Na2SO4)=n(BaSO4)=![]() =0.02mol,原混合溶液中c(Na2SO4)=
=0.02mol,原混合溶液中c(Na2SO4)=![]() =0.4mol/L。m(BaCO3)=14.51g-4.66g=9.85g,n(Na2CO3)=n(BaCO3)=
=0.4mol/L。m(BaCO3)=14.51g-4.66g=9.85g,n(Na2CO3)=n(BaCO3)=![]() =0.05mol,原混合溶液中c(Na2CO3)=
=0.05mol,原混合溶液中c(Na2CO3)=![]() =1mol/L。
=1mol/L。
(3)根據C守恒,n(CO2)=n(Na2CO3)=0.05mol,在標準狀況下CO2的體積為0.05mol![]() 22.4L/mol=1.12L。
22.4L/mol=1.12L。


 新編小學單元自測題系列答案
新編小學單元自測題系列答案 字詞句段篇系列答案
字詞句段篇系列答案科目:高中化學 來源: 題型:
【題目】某廠從廢催化劑(主要含Pt、Al2O3、石墨等)中回收海綿鉑和硫酸鋁晶體。工藝流程如下:
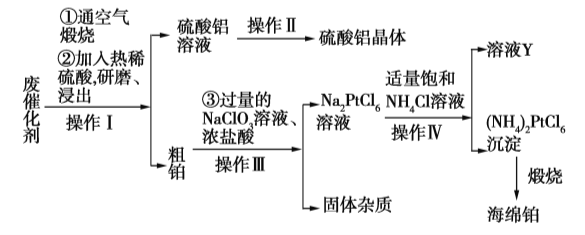
請回答下列問題:
(1)第①步通入空氣煅燒的目的是_____________________________。
(2)第②步用熱酸研磨浸出而不是直接浸出的原因是_____________________________。
(3)寫出第③步反應的離子方程式:_____________________________。
(4)此流程中的四個操作中有三個是相同的,其名稱是__________,在實驗室進行此操作使用的主要玻璃儀器有___________________。溶液Y中可以循環使用的物質是____________(填化學式)。
(5)用返滴定法測定硫酸鋁晶體中鋁的含量:稱取硫酸鋁晶體0.5400 g,用2.0 mL 3.0 mol·L1的硫酸溶解后制成250 mL溶液,取25.00 mL于錐形瓶中,加入0.02 mol·L1的EDTA標準液20.00 mL和緩沖溶液,加熱5 min,冷卻至室溫,加2滴二甲酚橙指示劑,用0.02 mol·L1的標準ZnSO4溶液滴定至終點消耗5.00 mL。則該晶體中鋁的質量分數為___________。(已知Al3+、Zn2+與EDTA反應的方程式如下:Al3++H2Y2![]() AlY+2H+,H2Y2+Zn2+
AlY+2H+,H2Y2+Zn2+![]() ZnY2+2H+)
ZnY2+2H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】核電荷數由小到大順序排列的五種短周期元素X、Y、Z、W、Q,其中在同周期中,Z的金屬性最強,Q的非金屬性最強;W的單質是淡黃色固體;X、Y、W在周期表中的相對位置關系如圖所示
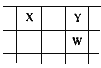
(1)五種元素形成的單質,其中固態時屬于原子晶體的是________(填化學式);常用作強氧化劑的是________、________(填化學式)。
(2)這五種元素中,原子半徑最大的是________(填化學式);由Z、W、Q形成的簡單離子半徑由大到小的順序是________(用化學式表示);X、W、Q的最高價氧化物的水化物酸性從強到弱的順序是________(用化學式表示)。
(3)Y和Z形成的一種化合物中含有離子鍵和共價鍵,請用電子書表示該化合物中化學鍵的形成過程___________________________________。
(4)Z與Q反應生成的化合物屬于________化合物;電解該化合物的飽和溶液,陽極的電極反應式為________;電解一段時間后,將陽極產物和陰極溶液混合,反應的化學方程式是______________。
(5)由X、Y和氫三種元素組成的化合物X6H12Y6,已知:9 g該化合物燃燒放出140 kJ的熱,寫出該化合物燃燒熱的熱化學方程式:_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種將燃料電池與電解池組合制備KMnO4的裝置如圖所示(電極甲、乙、丙、丁均為惰性電極)。該裝置工作時,下列說法不正確的是

A. 乙電極附近溶液的pH減小
B. 電極丁的反應式為:MnO42―― e- === MnO4-
C. KOH溶液的質量分數:c%>a%>b%
D. 導線中有2 mol電子通過時,理論上有2 mol K+移入陰極區
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在具有下列電子排布式的原子中,原子半徑最大的是( )
A. 1s22s22p63s23p1 B. 1s22s22p1 C. 1s22s22p3 D. 1s22s22p63s23p4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在無色的酸性溶液中,下列離子組能大量共存的是( )
A.Ba2+、K+、Cl-、NO3-
B.Fe3+、Na+、Cl-、S2-
C.Al3+、Na+、CO32-、NO3-
D.Fe2+、Mg2+、NO3-、SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】最近,全國特大“地溝油”案件宣判大快人心.“地溝油”中含有大量的油脂,油脂是多種高級脂肪酸的甘油酯.下列說法不正確的是
A.通過適當方法,可將“地溝油”用于生產燃料
B.地溝油有毒,不能回收利用,只能排入下水道
C.地溝油在堿性條件下可水解為甘油和高級脂肪酸鹽
D.地溝油可用作化工原料,如生產肥皂等產品
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com