
| A. | 1mol/L | B. | 2mol/L | C. | 2.5mol/L | D. | 3mol/L |
分析 鉑電極為惰性電極,電解HNO3與AgNO3 的混合溶液,通電一段時間后,兩極均收集到2.24L氣體(標準狀況),陰極發生2Ag++2e-=2Ag、2H++2e-=H2↑,陽極發生4OH--4e-=2H2O+O2↑,以此進行計算.
解答 解:鉑電極為惰性電極,電解HNO3與AgNO3 的混合溶液,通電一段時間后,兩極均收集到2.24L氣體(標準狀況),
n(氣體)=$\frac{2.24L}{22.4L/mol}$=0.1mol,由陽極發生4OH--4e-=2H2O+O2↑可知,生成0.1molO2轉移0.4mol電子,
根據電子守恒可知,陰極轉移0.4mol電子,則
2H++2e-=H2↑
0.2mol 0.1mol
2Ag++2e-=2Ag
0.2mol 0.2mol
即n(Ag+)=0.2mol,
則原混合溶液中Ag+的物質的量濃度為$\frac{0.2mol}{0.1L}$=2mol/L,
故選B.
點評 本題考查電解原理及氧化還原反應的計算,明確發生的電極反應及電子守恒是解答本題的關鍵,注意陰極銀離子先放電為解答的易錯點,題目難度中等.


 優學名師名題系列答案
優學名師名題系列答案科目:高中化學 來源: 題型:選擇題
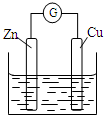
| A. | 銅電極上發生還原反應 | B. | 鋅電極是原電池的負極 | ||
| C. | 電子從銅極經過外電路流向鋅極 | D. | 鋅電極上的反應為Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該反應中反應物所具有的總能量高于生成物所具有的總能量 | |
| B. | 2 mol N原子結合生成N2(g)時需要放出946 kJ能量 | |
| C. | 1 mol NO(g)分子中的化學鍵斷裂時需要放出632 kJ能量 | |
| D. | 該反應的熱化學方程式為:N2+O2═2NO△H=+180 kJ/mol. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Rn的原子核內中子數與質子數的差值為50 | |
| B. | Rn位于元素周期表中第六周期0族 | |
| C. | Rn的最外層電子排布式為6s26p6,化學性質不活潑 | |
| D. | 新鋪大理石地面的居室,不用打開門窗換氣,因為氡對人體無危害 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
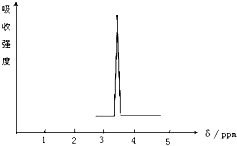 (1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氫譜圖如圖所示,則A的結構簡式為:CH2BrCH2Br,請預測B的核磁共振氫譜上有2個峰(信號).
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氫譜圖如圖所示,則A的結構簡式為:CH2BrCH2Br,請預測B的核磁共振氫譜上有2個峰(信號).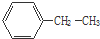 乙苯
乙苯
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 甲 | 乙 | 丙 | |
| 所含元素 | C、H | C、H、F | C、H、F |
| 所含電子數 | 26 | ||
| 結構特點 | 飽和有機物 | ||
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4 L O3含有分子的數目為NA | |
| B. | 常溫常壓下,4.0 g CH4中含有共價鍵的數目為NA | |
| C. | 在密閉容器中加入1.5 mol H2和0.5 molN2,充分反應后可得到NH3分子數為NA | |
| D. | 標準狀況下,2.24 L Cl2與足量NaOH溶液反應,轉移電子的數目為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋅錳干電池中石墨棒作負極 | |
| B. | 氫氧燃料電池工作時,氫氣在負極發生還原反應 | |
| C. | 鉛蓄電池放電時,兩極質量均增加 | |
| D. | 燃料電池的能量轉化率可達100% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com