
【題目】利用工業煉鉛產生的鋅灰(主要成分為ZnO、PbO、FeO、MnO2、CuO)可回收制備ZnCl2,工藝流程如下:
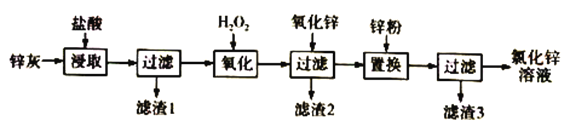
回答下列問題
(1)“浸取”實驗中,反應體系的溫度、反應時間對錳脫除效果的影響如下表,則適合的溫度和反應時間分別是________________、____________________。

(2)“濾渣1”的主要成分是_____________。
(3)H2O2溶液的作用是____________________________________,已知“濾渣2”的主要成分是Fe(OH)3,則氧化鋅的作用是_______________________________。“置換”實驗中發生的反應的離子方程式有Zn+Pb2+=Ph+Zn2+、___________________________________。
(4)由鋅灰制取金屬鋅可采用堿溶解,然后電解浸取液,已知:ZnO溶于NaOH溶液中生成[Zn(OH)4]2-,則陰極的電極反應為___________________________________。
(5)ZnCl2晶體溶解于飽和Na2CO3溶液中,得到6.46g的堿式碳酸鋅[Znx(CO3)y(OH)z,為了測定其組成,充分加熱分解,產生的氣體依次通入濃硫酸和堿石灰,質量分別增重了0.72g和0.88g,則該堿式碳酸鋅的化學式為______________________________。
【答案】 30℃ 2.0h MnO2 將Fe2+氧化為Fe3+ 調節pH將Fe3+轉化為沉淀除去 Zn+Cu2+==Zn2++Cu [Zn(OH)4]2-+2e-=Zn+4OH- Zn3CO3(OH)4
【解析】(1)“浸取”實驗中,根據表中反應體系的溫度、反應時間對錳脫除效果的數據可知,浸出率較高的適合的溫度和反應時間分別是30℃、2.0h;(2)MnO2不溶于稀鹽酸,故“濾渣1”的主要成分是MnO2;(3)H2O2溶液的作用是將Fe2+氧化為Fe3+,已知“濾渣2”的主要成分是Fe(OH)3,則氧化鋅的作用是調節pH將Fe3+轉化為沉淀除去;“置換”實驗中利用鋅置換出未處理的金屬性弱的金屬,發生的反應的離子方程式有Zn+Pb2+=Ph+Zn2+、Zn+Cu2+==Zn2++Cu;(4)陰極堿性條件下[Zn(OH)4]2-得到電子產生Zn,電極反應為[Zn(OH)4]2-+2e-=Zn+4OH-;(5)濃硫酸增重為分解生成水的質量,水的物質的量為![]() =0.04mol,則n(OH-)=0.08mol,堿石灰增重為分解得到二氧化碳的質量,二氧化碳物質為
=0.04mol,則n(OH-)=0.08mol,堿石灰增重為分解得到二氧化碳的質量,二氧化碳物質為![]() =0.02mol,則n(CO32-)=0.02mol,結合原子守恒,可知(Zn2+)=
=0.02mol,則n(CO32-)=0.02mol,結合原子守恒,可知(Zn2+)=![]() ×(0.08mol+0.02mol×2)=0.06mol,則x:y:z=0.06:0.02:0.08=3:1:4,故該堿式碳酸鋅的化學式為: Zn3CO3(OH)4。
×(0.08mol+0.02mol×2)=0.06mol,則x:y:z=0.06:0.02:0.08=3:1:4,故該堿式碳酸鋅的化學式為: Zn3CO3(OH)4。


科目:高中化學 來源: 題型:
【題目】H 是一種免疫調節劑,其合成流程如下:

問答下列問題:
(1)H所含官能團有氨基、羥基和______________。
(2)X的化學式為_______________,③的反應類型是_____________。
(3)設計反應①和⑤的目的是__________________。
(4)反應①為取代反應,其化學方程式為________________。
(5)R的同分異構體M同時滿足下列條件:
①M 能與氯化鐵溶液發生顯色反應
②1molM 最多能和4molNaOH 發生反應
③在核磁共振氫譜上有四組峰且峰的面積之為3:3:2:2
M 的結構簡式可能為________________。
(6)已知: ,結合上述相關信息,以
,結合上述相關信息,以 為原料設計合成路線合成
為原料設計合成路線合成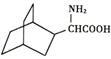 _________(其他試劑自選)。
_________(其他試劑自選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2 L的密閉容器中發生反應xA(g)+yB(g) ![]() zC(g)。圖甲表示200 ℃時容器中A、B、C物質的量隨時間的變化,圖乙表示不同溫度下平衡時C的體積分數隨起始n(A)∶n(B)的變化關系。則下列結論正確的是( )。
zC(g)。圖甲表示200 ℃時容器中A、B、C物質的量隨時間的變化,圖乙表示不同溫度下平衡時C的體積分數隨起始n(A)∶n(B)的變化關系。則下列結論正確的是( )。
A.200 ℃時,反應從開始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃時,該反應的平衡常數為25 L2/mol2
C.當外界條件由200℃降溫到100℃,原平衡一定被破壞,且正逆反應速率均增大
D.由圖乙可知,反應xA(g)+yB(g) ![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用下列裝置制備無水AlCl3(183℃升華),無水AlC13遇潮濕空氣即產生大量白霧。下列說法錯誤的是

A. b、c、f中依次盛裝飽和食鹽水、濃硫酸、濃硫酸
B. g中發生的反應為Cl2+2NaOH=NaCl+NaClO+H2O
C. e裝置的收集器必須保持干燥
D. 實驗時,a和d處酒精燈應同時點燃
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ、如何降低大氣中CO2的含量及有效地開發利用CO2引起了全世界的普遍重視。目前工業上有一種方法是用CO2來生產燃料甲醇。為探究該反應原理,進行如下實驗:在容積為1L的密閉容器中,充入1molCO2和3molH2 , 在500℃下發生發應,CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g)。實驗測得CO2和CH3OH(g)的物質的量(n)隨時間變化如下圖1所示:
CH3OH(g)+ H2O(g)。實驗測得CO2和CH3OH(g)的物質的量(n)隨時間變化如下圖1所示:
(1)從反應開始到平衡,氫氣的平均反應速率v(H2)=。
(2)500℃該反應的平衡常數為(結果保留一位小數),圖2是改變溫度時化學反應速率隨時間變化的示意圖,若提高溫度到800℃進行,達平衡時,K值(填“增大”“減小”或“不變”)。
(3)下列措施中不能使CO2的轉化率增大的是________________。
A.在原容器中再充入1mol H2
B.在原容器中再充入1molCO2
C.縮小容器的容積
D.使用更有效的催化劑
E.將水蒸氣從體系中分離出
(4)500℃條件下,測得某時刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的濃度均為0.5mol/L,則此時v(正) v(逆)(填“>”“<”或“=”)。
Ⅱ、一定條件下,可逆反應A2(g)+B2(g) ![]() 2C(g)達到平衡時,各物質的平衡濃度為c(A2)=0.5mol/L;c(B2)=0.1mol/L;c(C)=1.6mol/L。若用a、b、c分別表示A2、B2、C的初始濃度(mol/L),則:
2C(g)達到平衡時,各物質的平衡濃度為c(A2)=0.5mol/L;c(B2)=0.1mol/L;c(C)=1.6mol/L。若用a、b、c分別表示A2、B2、C的初始濃度(mol/L),則:
①a、b應滿足的關系是; ②a的取值范圍是。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來,磁性材料的研究備受國際磁學界的關注。Fe3O4具有許多優異的性能,在磁性材料等領域應用廣泛。回答下列問題:
(1)水熱法制備Fe3O=納米顆粒的總反應為3Fe2++2S2O32-+O2+4OHˉ=Fe3O4+S4O62-+2H2O,下列說法正確的是_________(填字母)
A.S2O32-是氧化劑
B.被氧化的Fe2+和未被氧化的Fe2+個數之比為1:2
C.每生成1 mol Fe 3O4,則轉移電子數為2mol
D.該反應中氧化劑與還原劑的物質的量之比為1:4
(2)已知:H2O(1)=H2(g)+1/2O2(g) △H1=+285.5kJ·mol-1,以太陽能為熱源分解Fe3O4,經由熱化學鐵氧化合物循環分解水制H2的過程如下:過程I的熱化學方程式為2Fe3O4(s) ![]() 6FeO(s)+O2(g) △H2=+313.2kJ·mol-1,則過程II的熱化學方程式為____________。
6FeO(s)+O2(g) △H2=+313.2kJ·mol-1,則過程II的熱化學方程式為____________。

(3)化學共沉淀法是制備Fe3O4顆粒最常用的方法之一,方法是將FeSO4和FeCl3溶液以1:2投料比混合,再加入NaOH溶液,即可產生Fe3O4顆粒,則該反應的離子方程式為______________________,由下表數據可知,Fe2+和Fe3+的最佳投料比為1:1.85,原因可能是_____________________。
表 不同投料比得到Fe3O4的結果

(4)磁鐵礦(Fe3O4)是工業上冶煉鐵的原料之一,發生的主要反應為Fe3O4(s)+4CO![]() 3Fe(s)+4CO2,該反應的△H<0,T℃時,在1L恒容密閉容器中,加入Fe3O4、CO各0.5mol,10min后反應達到平衡時,容器中CO2的濃度是0.4mol·L-1。
3Fe(s)+4CO2,該反應的△H<0,T℃時,在1L恒容密閉容器中,加入Fe3O4、CO各0.5mol,10min后反應達到平衡時,容器中CO2的濃度是0.4mol·L-1。
①CO的平衡轉化率是______________,T℃時,該反應的平衡常數K=__________。
②欲提高該反應中CO的平衡轉化率,可采取的措施是_____________(任寫一個即可)。
③其他條件不變時,該反應在不同溫度下,CO2含量隨時間的變化![]() (CO2)~t曲線如圖所示,溫度T1、T2、T3由大到小的關系是___________,判斷依據是____________。
(CO2)~t曲線如圖所示,溫度T1、T2、T3由大到小的關系是___________,判斷依據是____________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】建設美麗中國,倡導共同行動,努力改善環境,保護家園,下列說法正確的是
A. 把硝酸工廠的煙囪建造得更高一些,以避免氮氧化物的排放
B. 推廣燃煤發電,停建核電站,以防核泄漏事故發生
C. 將廢電池深埋,可以避免其中的重金屬污染
D. 燃煤中添加CaO,可以減少酸雨的產生
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是元素周期表的一部分,表中的①~⑨中元素,用元素符號或化學式填空回答:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ |
(1)在這些元素中,化學性質最不活潑的原子的原子結構示意圖為。
(2)地殼中含量最多的金屬元素是。
(3)②與④形成的化合物的電子式。
(4)這些元素中的最高價氧化物對應的水化物中,酸性最強的是 , 堿性最強的是 , 呈兩性的氫氧化物是。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SOCl2是一種重要氯化劑、鋰電池的正極材料,還可作水合鹽酸鹽的脫水劑。
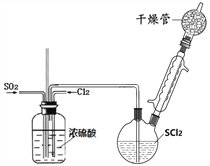
Ⅰ.一種模擬制備SOCl2裝置如上圖所示(夾持、加熱裝置略去),雙頸瓶中加入25.4mL SCl2,通入純凈干燥Cl2、SO2混合氣體,水浴條件下發生反應Cl2+SO2+SCl2=2SOCl2,幾種物質的部分性質如下表所示:
密度/ g﹒mL-1 | 熔點/℃ | 沸點/℃ | 備注 | |
SCl2 | 1.62 | -122 | 59 | 40℃分解,遇水分解 |
SOCl2 | 1.64 | -104.5 | 76 | 76℃分解,遇水分解 |
(1)洗氣瓶將氣體混合并干燥,還有___________作用。
(2)干燥管中堿石灰作用__________。
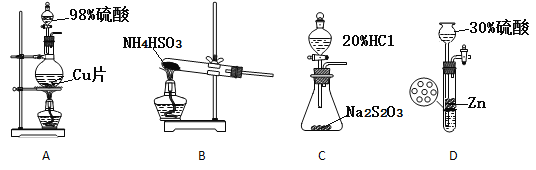
(3)實驗室制取SO2裝置和藥品應選擇____。
Ⅱ、雙頸瓶換毛細玻璃管和蒸餾頭,連接減壓蒸餾裝置,對粗產品減壓初蒸,剩余液體繼續減壓蒸餾獲得產品
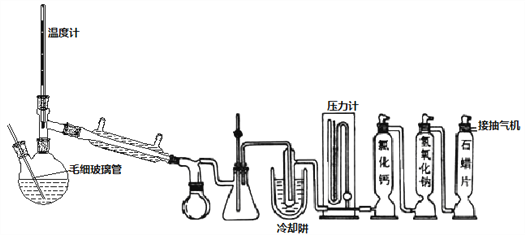
(4)不能用普通蒸餾方法分離混合物的原因是____。
(5)毛細玻璃管C作用是____________。初蒸水浴加熱的溫度應控制在____℃以下,再蒸餾獲得產品25.4mL,則SOCl2產率為__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com