
分析 n(H+)=0.2L×2mol/L×2+0.2L×1mol/L=1mol/L,n(NO3-)=0.4mol,n(Cu)=$\frac{9.6g}{24g/mol}$=0.4mol,結合3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O計算.
解答 解:(1)Cu與混合酸發生氧化還原反應,離子反應為3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案為:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)若9.6g銅粉反應,由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,
0.4molCu完全反應消耗0.4mol×$\frac{8}{3}$>1mol,消耗硝酸根離子為0.4mol×$\frac{2}{3}$<0.4mol,
則氫離子不足,理論上最多可收集到標況下的氣體體積為1mol×$\frac{2}{8}$×22.4L/mol=5.6L,
答:理論上最多可收集到標況下的氣體體積為5.6L.
點評 本題考查氧化還原反應的計算,為高頻考點,把握發生的離子反應及過量判斷為解答的關鍵,側重分析與計算能力的考查,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 若容積為某一固定值,當體系的壓強不再發生變化時說明達到化學平衡狀態 | |
| B. | 若上述可逆反應達化學平衡狀態后,給平衡體系加壓(縮小容積,其他條件不變),則容器內氣體的平均摩爾質量將減小 | |
| C. | 若上述可逆反應達到化學平衡狀態后,升高溫度(其他條件不變)體系顏色加深,則Q>0 | |
| D. | 對于上述可逆過程給平衡體系減壓(增大容積,其他條件不變),可以提高N2O4的產率 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
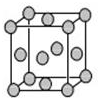 已知T、W、X、Y、Z是元素周期表前四周期中的常見元素,原子序數依次增大,相關信息如表.
已知T、W、X、Y、Z是元素周期表前四周期中的常見元素,原子序數依次增大,相關信息如表.| 元素 | 相關信息 |
| T | T元素可形成自然界硬度最大的單質 |
| W | W與T同周期,核外有一個未成對電子 |
| X | X原子的第一電離能至第四電離能分別是:I1=578kJ•mol-1,I2=1817kJ•mol-1, I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| Y | 常溫常壓下,Y單質是固體,其氧化物是形成酸雨的主要物質 |
| Z | Z的一種同位素的質量數為63,中子數為34 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
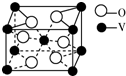 釩及其化合物非常豐富.釩可用于生產合金鋼、航天用的釩鈦合金及化工催化劑等.
釩及其化合物非常豐富.釩可用于生產合金鋼、航天用的釩鈦合金及化工催化劑等.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 晶胞是晶體結構中的基本結構單元 | |
| B. | 根據晶體的不同,晶胞可以是多種形狀的幾何體 | |
| C. | 晶胞一般都是平行六面體 | |
| D. | 晶胞都是正八面體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
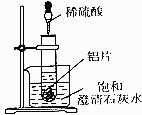 如圖所示,把試管放人盛有25℃飽和澄清石灰水的燒杯中,開始往試管中加人若干鋁片,再用滴管向試管中加人10mL1mol•L-1稀硫酸.
如圖所示,把試管放人盛有25℃飽和澄清石灰水的燒杯中,開始往試管中加人若干鋁片,再用滴管向試管中加人10mL1mol•L-1稀硫酸.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | M 中一定不含Mg(OH)2 | B. | M中一定含有MgCO3 | ||
| C. | 5.78 g M中含CaCO30.05mol | D. | 水垢中碳酸鹽質量分數為0.823 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
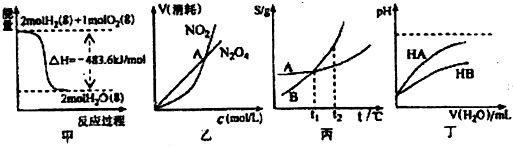
| A. | 甲表示H2與O2發生反應過程中的能量變化,則H2的燃燒熱為483.6kJ•mol-l | |
| B. | 乙表示恒溫恒容條件下發生的可逆反應2NO2?N2O4(g)中,各物質的濃度與其消耗速率之間的關系,其中交點A對應的狀態為化學平衡狀態 | |
| C. | 丙表示A、B兩物質的溶解度隨溫度變化情況,將A、B飽和溶液分別由t1℃升溫至t2℃時,溶質的質量分數B=A | |
| D. | 丁表示常溫下,稀釋HA、HB兩種酸的稀溶液時,溶液pH隨加水量的變化,則同濃度的NaA溶液的pH大于NaB溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com