
【題目】廢棄物的回收利用可實現資源再生,并減少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷電路板金屬粉末中的銅.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJmol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196kJmol-1
H2(g)+![]() O2(g)═H2O(l)△H=-285kJmol-1
O2(g)═H2O(l)△H=-285kJmol-1
在H2SO4溶液中,Cu與H2O2反應生成Cu2+和H2O的熱化學方程式為__________________
(2)①在提純后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加熱,生成CuCl(氯化亞銅)沉淀,同時溶液的酸性增強.制備CuCl的離子方程式是___________
②在![]() 硫酸銅溶液中加入氫氧化鈉稀溶液充分攪拌,有淺藍色氫氧化銅沉淀生成,當溶液的pH=9時,
硫酸銅溶液中加入氫氧化鈉稀溶液充分攪拌,有淺藍色氫氧化銅沉淀生成,當溶液的pH=9時,![]() ________ mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)
________ mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)
③若在0.15![]() 硫酸銅溶液中通入過量
硫酸銅溶液中通入過量![]() 氣體,使
氣體,使![]() 完全沉淀為CuS,此時溶液中的
完全沉淀為CuS,此時溶液中的![]() 濃度是______
濃度是______![]()
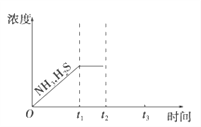
(3)工業上常用氨水吸收H2S進行廢氣脫硫,生成NH4HS。一定溫度下1molNH4HS固體在定容真空容器中可部分分解為硫化氫和氨氣。下圖1是上述反應過程中生成物濃度隨時間變化的示意圖。若t2時增大氨氣的濃度且在t3時反應再次達到平衡,請在圖1上畫出t2時刻后氨氣、硫化氫的濃度隨時間的變化曲線_________________________。
(4)可利用H2S廢氣進行高溫熱分解制取氫氣,實現化廢為寶。
已知:![]()
在恒溫密閉容器中,控制不同溫度進行![]() 分解實驗。以
分解實驗。以![]() 起始濃度均為0.2
起始濃度均為0.2 ![]() 測定
測定![]() 的轉化率,結果見下圖。
的轉化率,結果見下圖。

圖中a為![]() 的平衡轉化率與溫度關系曲線,b曲線表示不同溫度下反應經過相同時間且未達到化學平衡時
的平衡轉化率與溫度關系曲線,b曲線表示不同溫度下反應經過相同時間且未達到化學平衡時![]() 的轉化率。據圖計算985℃時
的轉化率。據圖計算985℃時![]() 按上述反應分解的平衡常數K=______(保留2位有效數字);說明隨溫度的升高,曲線b向曲線a逼近的原因:_________________________。
按上述反應分解的平衡常數K=______(保留2位有效數字);說明隨溫度的升高,曲線b向曲線a逼近的原因:_________________________。
【答案】 Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319kJmol-1 2Cu2++SO32-+2Cl-+H2O==2CuCl↓+SO42-+2H+ 2.2×10-10 0.30 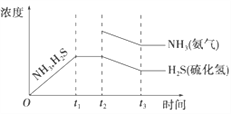 0.13 溫度升高,反應速率加快,達到平衡所需的時間縮短
0.13 溫度升高,反應速率加快,達到平衡所需的時間縮短
【解析】(1). 已知:① Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJmol-1、② 2H2O2(l)═2H2O(l)+O2(g)△H=-196kJmol-1、③ H2(g)+![]() O2(g)═H2O(l)△H=-285kJmol-1,根據蓋斯定律,①+②÷2+③得:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319kJmol-1,故答案為:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319kJmol-1;
O2(g)═H2O(l)△H=-285kJmol-1,根據蓋斯定律,①+②÷2+③得:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319kJmol-1,故答案為:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319kJmol-1;
(2). ①. 由題中信息可知,CuSO4中的Cu元素從+2價降低到+1價,Na2SO3中的S元素從+4價升高到+6價,根據得失電子守恒和原子守恒,該反應的離子方程式為:2Cu2++SO32-+2Cl-+H2O==2CuCl↓+SO42-+2H+,故答案為:2Cu2++SO32-+2Cl-+H2O==2CuCl↓+SO42-+2H+;
②. 溶液pH=9, c(OH-)=10-5mol/L,當有氫氧化銅沉淀生成時,c(Cu2+)=![]() =
=![]() =2.2×10-10mol/L,故答案為:2.2×10-10;
=2.2×10-10mol/L,故答案為:2.2×10-10;
③. 在0.15mol/L硫酸銅溶液中通入過量H2S氣體,使Cu2+完全轉化為CuS沉淀,反應的化學方程式為:CuSO4+H2S=CuS↓+H2SO4,此時溶液中的溶質為硫酸,c(SO42-)不變,仍然為0.15mol/L,由硫酸的化學式可知,溶液中的c(H+)=0.3mol/L,故答案為:0.3;
(3). 若t2時增大氨氣的濃度,氨氣的濃度突然增大,在這一瞬間硫化氫的濃度不變,然后平衡逆向移動,氨氣的濃度和硫化氫的濃度都減小,再次達到平衡時,氨的濃度比原平衡的濃度要高,且NH3與H2S濃度的降低比例是相同的,即圖象中的斜率相同,則圖象為: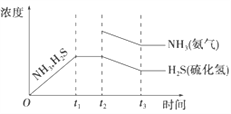 ,故答案為:
,故答案為: ;
;
(4). 以H2S起始濃度均為0.2molL1測定H2S的轉化率,985℃時H2S的轉化率為40%,則
H2S(g) H2(g) + ![]() S2(g),
S2(g),
起始濃度(mol/L) 0.2 0 0
轉化濃度(mol/L) 0.08 0.08 0.04
平衡濃度(mol/L) 0.12 0.08 0.04
由反應方程式可知,該分解反應的平衡常數K=![]() =0.13,隨著溫度的升高,反應速率加快,達到平衡時需要的時間縮短,所以曲線b向曲線a逼近,故答案為:0.13;溫度升高,反應速率加快,達到平衡所需的時間縮短。
=0.13,隨著溫度的升高,反應速率加快,達到平衡時需要的時間縮短,所以曲線b向曲線a逼近,故答案為:0.13;溫度升高,反應速率加快,達到平衡所需的時間縮短。


科目:高中化學 來源: 題型:
【題目】
第四周期的過渡元素在工業、農業、科學技術以及人類生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的電熱元件材料。請回答:
(1) 基態Ni原子核外電子排布式為________;第二周期中基態原子未成對電子數與Ni相同且電負性大的元素為________ 。
(2) 金屬Ni粉在CO氣流中輕微加熱,生成無色揮發性液態Ni(CO)4,該分子呈正四面體構型。試推斷Ni(CO)4的晶體類型為_____,Ni(CO)4 易 溶于下列_____ (填選項字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸鎳溶液
(3) FeO、NiO 晶體中r(Ni2+)和r(Fe2+)分別為69pm 和78pm,則熔點NiO__FeO(填“>"或“<”),原因為_________ 。
(4) 黃血鹽是一種配合物,其化學式為K4[Fe(CN)6]·3H2O,該配合物中配體的化學式為_________,黃血鹽溶液與稀硫酸加熱時發生非氧化還原反應,生成硫酸鹽和一種與該配體互為等電子體的氣態化合物,該反應的化學方程式為_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,鄰硝基苯酚和對硝基苯酚在20℃水中的溶解度之比為0.39,其原因為________。
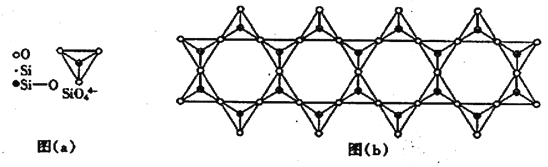
(6) 在鉻的硅酸鹽中,SiO44-四面體如下圖(a)通過共用頂角氧離子可形成島狀、鏈狀、層狀、骨架網狀四大結構型式。圖(b)為一種鏈狀結構的多硅酸根,其中硅原子的雜化形式為_______,其化學式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉬酸鈉晶體(Na2MoO4·2H2O)是無公害型冷卻水系統的金屬緩蝕劑,由鉬精礦(主要成分是MoS2,含少量PbS等)制備鉬酸鈉晶體的部分流程如圖所示:
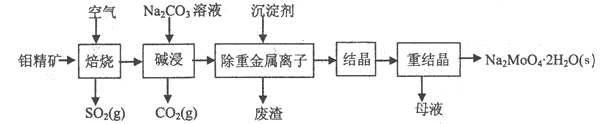
(1)Na2MoO4·2H2O中鉬元素的化合價為______;
(2)焙燒時為了使鉬精礦充分反應,可采取的措施是_______(答出一條即可);
(3)試配平焙燒過程中鉬精礦發生的主要反應的化學方程式
為__MoS2+__O2![]() __MoO3+___SO2,該反應中氧化產物是________(填化學式)
__MoO3+___SO2,該反應中氧化產物是________(填化學式)
(4)堿浸時,MoO3與Na2CO3溶液反應的離子方程式為___________;
(5)下圖是碳鋼在3種不同介質中的腐蝕速率實驗結果:
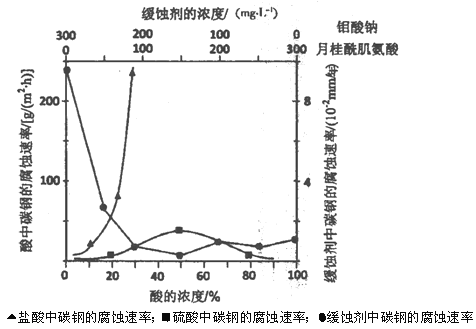
①碳鋼在鹽酸和硫酸中腐蝕速率隨酸的濃度變化有明顯差異,其原因可能是____。
②空氣中鉬酸鹽對碳鋼的緩蝕原理是在鋼鐵表面形成FeMoO4—Fe2O3保護膜。
密閉式循環冷卻水系統中的碳鋼管道緩蝕,除需加入鉬酸鹽外還需加入NaNO2。則NaNO2的作用是__。
(6)鋰和二硫化鉬形成的二次電池的總反應為:xLi+nMoS2![]() Lix(MoS2)n。則電池放電時的正極反應式是:__________________。
Lix(MoS2)n。則電池放電時的正極反應式是:__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
鈾是原子反應堆的原料,常見鈾的化合物有UF4、UO2及(NH4)4【UO2(CO3)3】等。回答下列問題:
(1) UF4用Mg或Ca還原可得金屬鈾。金屬鈾的一種堆積方式為體心立方堆積,該堆積方式的空間利用率為__________________;基態鈣原子核外電子排布式為_________________;熔點:MgO(2852℃)高于CaO(2614℃),其原因是_____________________________。
(2) ![]() 。NH4HF2中所含作用力有____________(填字母)。
。NH4HF2中所含作用力有____________(填字母)。
a. 氫鍵 b. 配位鍵 c. 共價鍵 d. 離子鍵 e. 金屬鍵
(3)已知:![]() .
.
①NH4+ 的空間構型為__________________,與NH4+ 互為等電子體的分子或離子有________(寫兩種)
②CO32- 中碳原子雜化軌道類型為______________________。
③分解產物中屬于非極性分子的是_____________________(填字母)。
a. NH3 b. CO2 c. N2 d. H2O
(4) UO2 的晶胞結構及晶胞參數如下圖所示:
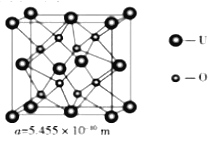
①晶胞中U的配位數為_________________。
②UO2 的密度為_________________g·cm-3(列出計算式即可,用NA表示阿伏伽德羅常數的值)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】部分弱酸的電離平衡常數如下表:
弱酸 | HCOOH | HClO |
|
|
電離平衡常數 |
|
|
|
|
(1)室溫下![]()
![]()
![]()
![]()
![]() 溶液的pH由大到小的關系為______.
溶液的pH由大到小的關系為______.
(2)濃度均為![]() 的
的![]() 和
和![]() 的混合溶液中,
的混合溶液中, ![]() 、
、![]() 、
、![]() 、
、![]() 濃度從大到小的順序為______.
濃度從大到小的順序為______.
(3)少量![]() 通入到過量的NaClO溶液中發生反應的離子方程式______.
通入到過量的NaClO溶液中發生反應的離子方程式______.
(4)常溫下, ![]() 的HCOOH溶液與
的HCOOH溶液與![]() 的NaOH溶液等體積混合后,溶液中離子濃度由大到小的順序為______.
的NaOH溶液等體積混合后,溶液中離子濃度由大到小的順序為______.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機化合物A是一種農藥生產的中間體,A在一定條件下可發生如圖轉化:

請回答下列問題:
(1)![]() 分子中不含氧官能團的名稱為 ______ .
分子中不含氧官能團的名稱為 ______ .
(2)![]() 不能發生反應的類型有 ______
不能發生反應的類型有 ______ ![]() 填字母
填字母![]() .
.
![]() 取代反應
取代反應![]() 消去反應
消去反應![]() 加成反應
加成反應![]() 氧化反應
氧化反應
(3)反應![]() 的化學方程式為 ______ .
的化學方程式為 ______ .
(4)寫出B到C的離子方程式 ______ .
(5)![]() 在一定條件下反應能生成高分子化合物,寫出此高分子化合物所有可能的結構簡式: ______ .
在一定條件下反應能生成高分子化合物,寫出此高分子化合物所有可能的結構簡式: ______ .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下V L氨氣溶解在1 L水中(水的密度近似為1 g·mL-1),所得溶液的密度為ρ g·mL-1,質量分數為w,物質的量濃度為c mol·L-1,則下列關系中不正確的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com