
二氧化硫是硫的重要化合物,在生產、生活中有廣泛應用。二氧化硫有毒,并且是形成酸雨的主要氣體。無論是實驗室制備還是工業生產,二氧化硫尾氣吸收或煙氣脫硫都非常重要。
完成下列填空:
(1)實驗室可用銅和濃硫酸加熱或硫酸和亞硫酸鈉反應制取二氧化硫。
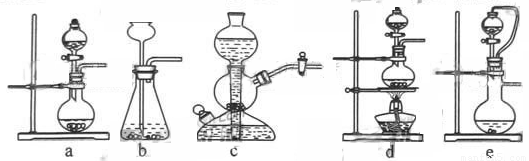
如果用硫酸和亞硫酸鈉反應制取二氧化硫,并希望能控制反應速度,上圖中可選用的發生裝置
是 (填寫字母)。
(2)若用硫酸和亞硫酸鈉反應制取3.36L(標準狀況)二氧化硫,至少需要稱取亞硫酸鈉 g(保留一位小數);如果已有4.0%亞硫酸鈉(質量分數),被氧化成硫酸鈉,則至少需稱取該亞硫酸鈉 g (保留一位小數)。
(3)實驗室二氧化硫尾氣吸收與工業煙氣脫硫的化學原理相通。石灰-石膏法和堿法是常用的煙氣脫硫法。
石灰-石膏法的吸收反應為SO2+Ca(OH)2→CaSO3↓+H2O。吸收產物亞硫酸鈣由管道輸送至氧化塔氧化,反應為2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下圖:
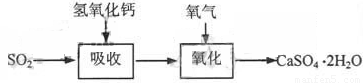
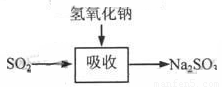
堿法的吸收反應為SO2+2NaOH→Na2SO3+H2O。堿法的特點是氫氧化鈉堿性強、吸收快、效率高。其流程如下圖:
已知:
|
試劑 |
Ca(OH)2 |
NaOH |
|
價格(元/kg) |
0.36 |
2.9 |
|
吸收SO2的成本(元/mol) |
0.027 |
0.232 |
石灰-石膏法和堿法吸收二氧化硫的化學原理相同之處是 。和堿法相比,石灰-石膏法的優點是 ,缺點是 。
(4)在石灰-石膏法和堿法的基礎上,設計一個改進的、能實現物料循環的煙氣脫硫方案(用流程圖表示)。
(1)ae。
(2)18.9,19.8
(3)酸性氧化物與堿的反應。成本低;亞硫酸鈣在輸送中容易造成管道堵塞。
(4)
【解析】用硫酸和亞硫酸鈉反應制取二氧化硫是利用固液不加熱制取氣體裝置,因此選ae;
H2SO4+Na2SO3=Na2SO4+SO2+H2O
126g 22.4L
m 3.36L,m=18.9g,
設含4.0%的亞硫酸鈉的樣品質量為100g,則生成硫酸鈉的質量為4.5g,則這時亞硫酸鈉的質量分數為(100-4.0)/(100-4.0+4.5)=96/100.5,則至少需稱取該亞硫酸鈉18.9×100.5/96=19.8g。石灰-石膏法的優點是成本低;缺點是亞硫酸鈣在輸送中容易造成管道堵塞
【考點定位】本題以二氧化硫煙氣處理為情景考查裝置選擇、計算、成本核算、方案設計及分析問題解決問題的能力。


 ABC考王全優卷系列答案
ABC考王全優卷系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| ||
| ||
| △ |
| ||
| △ |
| ||||
|
| ||||
|
查看答案和解析>>
科目:高中化學 來源:2013屆天津市天津一中高三第四次月考化學試卷(帶解析) 題型:實驗題
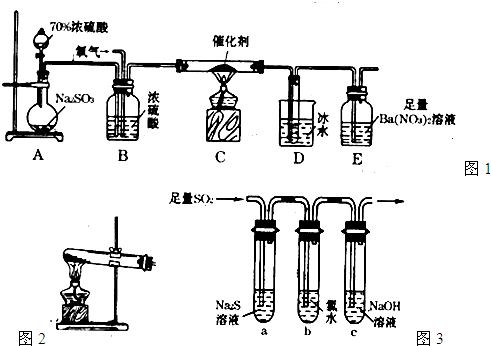
二氧化硫是重要的工業原料,探究其制備方法和性質具有非常重要的意義。
(1)工業上用黃鐵礦(FeS2,其中S元素為-l價)在高溫下和氧氣反應制備SO2: ,該反應中被氧化的元素是 (填元素符號)。當該反應轉移2.75mol電子時,生成的二氧化硫在標準狀況下的體積為 L。
,該反應中被氧化的元素是 (填元素符號)。當該反應轉移2.75mol電子時,生成的二氧化硫在標準狀況下的體積為 L。
(2)實驗室中用下列裝置測定SO2催化氧化為SO3的轉化率。(已知SO3熔點為16. 8℃,假設氣體進入裝置時分別被完全吸收,且忽略空氣中CO2的影響。) 
①簡述使用分液漏斗向圓底燒瓶中滴加濃硫酸的操作是 。
②實驗過程中,需要通入氧氣。試寫出一個用右圖所示裝置制取氧氣的化學方程式 。
③當停止通入SO2,熄滅酒精燈后,需要繼續通一段時間的氧氣,其目的是 。
④實驗結束后,若裝置D增加的質量為m g,裝置E中產生白色沉淀的質量為n g,則此條件下二氧化硫的轉化率是 (用含字母的代數式表示,不用化簡)。
(3)某學習小組設計用如右圖裝置驗證二氧化硫的化學性質。
①能說明二氧化硫具有氧化性的實驗現象為 。
②為驗證二氧化硫的還原性,充分反應后,取試管b中的溶液分成三份,分別進行如下實驗: 
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品紅溶液,紅色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,產生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”);試管b中發生反應的離子方程式為 。
③當通入二氧化硫至試管c中溶液顯中性時,該溶液中c(Na+)= (用含硫微粒濃度的代數式表示)。)】
查看答案和解析>>
科目:高中化學 來源:2012-2013學年江蘇省蘇錫常鎮四市高三教學情況調研(二)化學試卷(解析版) 題型:填空題
銅、碳、氮、硫、氯等是組成物質的重要元素。
(1)S、Cl組成的一種化合物的分子結構與H2O2相似,則此化合物的結構式為 。
N、O、S三種元素的電負性由大到小的順序為 。
(2)銅離子是人體內多種酶的輔因子,人工模擬酶是當前研究的熱點。某化合物Y 與Cu(Ⅰ)(Ⅰ表示化合價為+1)結合形成圖所示的離子:
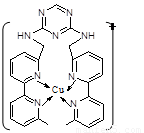
①寫出Cu(Ⅰ)的電子排布式 ;
②該離子中含有化學鍵的類型有 (選填序號);
A.極性鍵 B.離子鍵 C.非極性鍵 D.配位鍵
③該離子中C原子的雜化方式有 。
(3)向氯化銅溶液中通入足量的二氧化硫,生成白色沉淀M,M的結構如圖所示。寫出該反應的離子方程式 。

查看答案和解析>>
科目:高中化學 來源:2012-2013學年天津市高三第四次月考化學試卷(解析版) 題型:實驗題
二氧化硫是重要的工業原料,探究其制備方法和性質具有非常重要的意義。
(1)工業上用黃鐵礦(FeS2,其中S元素為-l價)在高溫下和氧氣反應制備SO2:
 ,該反應中被氧化的元素是 (填元素符號)。當該反應轉移2.75mol電子時,生成的二氧化硫在標準狀況下的體積為 L。
,該反應中被氧化的元素是 (填元素符號)。當該反應轉移2.75mol電子時,生成的二氧化硫在標準狀況下的體積為 L。
(2)實驗室中用下列裝置測定SO2催化氧化為SO3的轉化率。(已知SO3熔點為16. 8℃,假設氣體進入裝置時分別被完全吸收,且忽略空氣中CO2的影響。)

①簡述使用分液漏斗向圓底燒瓶中滴加濃硫酸的操作是 。
②實驗過程中,需要通入氧氣。試寫出一個用右圖所示裝置制取氧氣的化學方程式 。

③當停止通入SO2,熄滅酒精燈后,需要繼續通一段時間的氧氣,其目的是 。
④實驗結束后,若裝置D增加的質量為m g,裝置E中產生白色沉淀的質量為n g,則此條件下二氧化硫的轉化率是 (用含字母的代數式表示,不用化簡)。
(3)某學習小組設計用如右圖裝置驗證二氧化硫的化學性質。
①能說明二氧化硫具有氧化性的實驗現象為 。
②為驗證二氧化硫的還原性,充分反應后,取試管b中的溶液分成三份,分別進行如下實驗:

方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品紅溶液,紅色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,產生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”);試管b中發生反應的離子方程式為 。
③當通入二氧化硫至試管c中溶液顯中性時,該溶液中c(Na+)= (用含硫微粒濃度的代數式表示)。)】
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com