
【題目】水合肼(N2H4·H2O)是一種無色易溶于水的油狀液體,具有堿性和極強的還原性,在工業生產中應用非常廣泛。
(1)肼(N2H4)是一種火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g); △H=+67.7 kJ·mol-1
N2H4(g)+O(g)=N2(g)+2H2O(g); △H=-534.0 kJ·mol-1
NO2(g)=![]() N2O4(g); △H=-28.0 kJ·mol-1
N2O4(g); △H=-28.0 kJ·mol-1
反應2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)的△H=________kJ·mol-1。
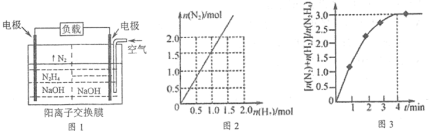
(2)目前正在研發的高能量密度燃料電池車是以水合肼燃料電池作為動力來源,電池結構如圖1所示。
①起始時正極區與負極區NaOH溶液濃度相同,工作一段時間后,NaOH濃度較大的是___(填“正”或“負”)極區。
②該電池負極的電極反應式為_____________。
(3)已知水合肼是二元弱堿(25℃,K1=5×10-7,K2=5×10-15),0.1 mol·L-1水合肼溶液中四種離子:①H+、②OH-、③![]() 、④
、④![]() 的濃度從大到小的順序為_________(填序號)。
的濃度從大到小的順序為_________(填序號)。
(4)在弱酸性條件下水合肼可處理電鍍廢水,將![]() 還原為Cr(OH)3沉淀而除去,水合肼被氧化為N2,該反應的離子方程式為___________________。
還原為Cr(OH)3沉淀而除去,水合肼被氧化為N2,該反應的離子方程式為___________________。
(5)肼是一種優良的貯氫材料,其在不同條件下分解方式不同。
①在高溫下,N2H4可完全分解為NH3、N2及H2,實驗測得分解產物中N2與H2物質的量變化如圖2所示,該分解反應方程式為__________________。
②在303K,NiPt催化下,則發生N2H4(l)![]() N2(g)+2H2(g)。在2L密閉容器中加入1 mol N2H4,測得容器中
N2(g)+2H2(g)。在2L密閉容器中加入1 mol N2H4,測得容器中![]() 與時間關系如圖3所示。則0~4 min氮氣的平均速率v(N2)=____________。
與時間關系如圖3所示。則0~4 min氮氣的平均速率v(N2)=____________。
【答案】-1079.7 正 N2H4+4OH--4e-=N2↑+4H2O ②③④① 2![]() +4H++3N2H4·H2O=4Cr(OH)3↓+3N2↑+5H2O 7N2H4(g)
+4H++3N2H4·H2O=4Cr(OH)3↓+3N2↑+5H2O 7N2H4(g)![]() 8NH3(g)+3N2(g)+2H2(g) 0.0625mol·L-1·min-1
8NH3(g)+3N2(g)+2H2(g) 0.0625mol·L-1·min-1
【解析】
(1)已知a.N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol,
b.N2H4(g)+O(g)=N2(g)+2H2O(g) △H=-534.0kJ/mol,
c.NO2(g)=![]() N2O4(g) △H=-28.0 kJ·mol-1,
N2O4(g) △H=-28.0 kJ·mol-1,
由蓋斯定律b×2-a-c×2得到:熱化學方程式:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1079.7kJ/mol;
(2)①負極發生氧化反應,肼失電子和氫氧根離子反應生成氮氣和水,電極反應式為N2H4+4OH--4e-=4H2O+N2↑,正極是氧氣得電子發生還原反應,正極反應為:O2+2H2O+4e-=4OH-,根據電極反應式可知工作一段時間后,正極區NaOH濃度較大;
②負極發生氧化反應,肼失電子和氫氧根離子反應生成氮氣和水,電極反應式為N2H4+4OH--4e-=4H2O+N2↑;
(3)水合肼是二元弱堿,分步電離:N2H4·H2O![]()
![]() +OHˉ、
+OHˉ、![]() ·H2O
·H2O![]()
![]() +OHˉ,第一步電離會抑制第二步電離,兩步電離均產生氫氧根,所以離子的濃度大小為:c(OHˉ)>c(
+OHˉ,第一步電離會抑制第二步電離,兩步電離均產生氫氧根,所以離子的濃度大小為:c(OHˉ)>c(![]() )>c(
)>c(![]() )>c(H+),即②③④①;
)>c(H+),即②③④①;
(4)N2H4·H2O被氧化成N2,每個N化合價升高2價,共升高4價;![]() 被還原為Cr(OH)3,每個Cr降低3價,共降低6價,所以二者系數比為3:2,再結合元素守恒可得離子方程式為2
被還原為Cr(OH)3,每個Cr降低3價,共降低6價,所以二者系數比為3:2,再結合元素守恒可得離子方程式為2![]() +4H++3N2H4·H2O=4Cr(OH)3↓+3N2↑+5H2O;
+4H++3N2H4·H2O=4Cr(OH)3↓+3N2↑+5H2O;
(5)①據圖可知相同時間內△n(H2):△n(N2)=2:3,再結合元素守恒可得該分解反應方程式為:7N2H4(g)![]() 8NH3(g)+3N2(g)+2H2(g);
8NH3(g)+3N2(g)+2H2(g);
②設0~4 min△n(N2H4)=a mol,剩余的n(N2H4)=(1-a)mol根據方程式可知△n(H2)=2a mol,△n(N2)=a mol,則有![]() =3,解得a=0.5,所以0~4 min△n(N2)=0.5mol,容器體積為2L,所以v(N2)=
=3,解得a=0.5,所以0~4 min△n(N2)=0.5mol,容器體積為2L,所以v(N2)=![]() = 0.0625mol·L-1·min-1。
= 0.0625mol·L-1·min-1。


科目:高中化學 來源: 題型:
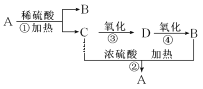
【題目】常見有機物A~D有下圖轉化關系(部分反應條件和部分產物已略去)。已知A是一種酯,其分子式為C4H8O2,B是食醋的主要成分。
請回答下列問題:
(1)寫出C和D含有的官能團名稱___________、_____________;
(2)寫出B和D的結構簡式___________、_____________;
(3)寫出B和C生成A的化學方程式___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符的是

A. 圖1表示0.2mol MgCl2·6H2O在空氣中充分加熱時固體質量隨時間的變化
B. 圖2表示用0.1000mo1· L—1NaOH溶液滴定25.00mLCH3COOH的滴定曲線,則c(CH3COOH)=0.100 mo1· L—1
C. 圖3表示常溫下,稀釋HA、HB兩種酸的稀溶液時,溶液pH隨加水量的變化,則常溫下,NaA溶液的pH小于同濃度的NaB溶液的pH
D. 圖4表示恒溫恒容條件下,2NO2(g) ![]() N2O4(g)中,各物質的濃度與其消耗速率之間的關系,其中交點A對應的狀態為化學平衡狀態
N2O4(g)中,各物質的濃度與其消耗速率之間的關系,其中交點A對應的狀態為化學平衡狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸鹽與鈷(Ⅲ)形成的一種配合物[Co(NH3)5NO2]Cl2的制備流程如下:
CoCl2·6H2O![]() [Co(NH3)5Cl]Cl2
[Co(NH3)5Cl]Cl2![]() [Co(NH3)5NO2]Cl2
[Co(NH3)5NO2]Cl2
(1)Co2+基態核外電子排布式為___。
(2)配合物[Co(NH3)5Cl]Cl2中與Co3+形成配位鍵的原子為___(填元素符號);配離子[Co(NH3)5NO2]2+的配體中氮原子的雜化軌道類型為___。
(3)NO![]() 的空間構型為___,與它互為等電子體的分子為___(寫化學式)。
的空間構型為___,與它互為等電子體的分子為___(寫化學式)。
(4)H2O2與H2O可以任意比例互溶,除因為它們都是極性分子外,還因為___。
(5)1mol[Co(NH3)5Cl]Cl2中含有σ鍵的數目為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,用0.100mol/L NaOH 溶液分別滴定20.00mL 0.100mol/L的鹽酸和醋酸,滴定曲線如圖所示.下列說法正確的是

A. Ⅰ、Ⅱ分別表示鹽酸和醋酸的滴定曲線
B. V(NaOH)=10.00 mL 時 >1
>1
C. pH=7時,兩種酸所用NaOH溶液的體積相等
D. V(NaOH)=20.00 mL 時,c(Cl-)<c(CH3COO-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】重鉻酸鈉是一種用途極廣的強氧化劑,工業上可以用鉻鐵礦[主要成分為Fe(CrO2)2或FeO·Cr2O3,還含有Al2O3、Fe2O3、SiO2等雜質]制備,其主要工藝流程如圖所示。請回答下列問題:

(1)煅燒鉻鐵礦生成Na2CrO4的化學方程式為______________________。
(2)調節溶液的pH所選的試劑為___________(填名稱),寫出生成Al(OH)3的化學方程式______________________。
(3)Na2CrO4溶液酸化時發生反應2CrO42-(黃色)+2H+![]() Cr2O72-(橙紅色)+H2O。
Cr2O72-(橙紅色)+H2O。
①該反應___________氧化還原反應(填“是”或“不是”),反應的平衡常數表達式:K=___________。
②若向Na2Cr2O7溶液(橙紅色)中加入足量的NaOH固體,溶液___________(填標號)
A 變黃色 B 顏色不變 C 變紅色溶液
③已知:25℃時,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7,的Ksp=2×10-7。25℃時,向Na2Cr2O7溶液中加入AgNO3溶液,生成磚紅色沉淀,且溶液酸性增強,該沉淀的化學式是___________。
(4)用重鉻酸鈉(Na2Cr2O7)結晶后的母液生產重鉻酸鉀的反應為Na2Cr2O7+2KCl=K2Cr2O7+2NaCl,結合溶解度圖回答,冷卻結晶析出大量K2Cr2O7的原因是___________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某廠廢酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+ 。利用該廢液制備過二硫酸銨[( NH4) 2S2O8]和TiO2的一種工藝流程如下:

已知:i.TiOSO4在熱水中易水解生成H2TiO3,相關離子形成氫氧化物沉淀的pH范圍如 下表:
金屬離子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
開始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii. pH>7 時,Fe2+部分生成 Fe( Ⅱ)氨絡離Fe(NH3)2]2+o
請回答下列問題:
(1)加入適量Fe的作用是________________ .
(2)生成TiO(OH)2的化學方程式為_______________ 。
(3)濾渣I、濾渣II均含有的物質的化學式為_____________ .
(4)加入H2O2的目的是除掉Fe( Ⅱ)氨絡離子[Fe(NH3)2]2+,此過程中氧化劑與還原劑的物質的量之比理論上等于________ (填數值)。
(5)常溫下,含硫微粒主要存在形式與pH的關系如下圖所示。

用Pt電極電解飽和NH4HSO4溶液制備過二硫酸銨時,為滿足在陽極放電的離子主要為 HSO4-,應調節陽極區溶液的pH范圍在______之間,其電極反應式為____________ 。
(6)科研人員常用硫酸鐵銨[NH4Fe(SO4)2]滴定法測定TiO2的純度,其步驟為: 用足量酸溶解wg 二氧化鈦樣品,用鋁粉做還原劑,過濾、洗滌,將濾液定容為100 mL,取 25.00 mL,以NH4SCN作指示劑,用標準硫酸鐵銨溶液滴定至終點,反應原理為: Ti3++Fe3+=Ti4++Fe2+。
①判斷滴定終點的方法:________________________ 。
②滴定終點時消耗c mol/L-1 NH4Fe(SO4)2溶液VmL,則TiO2純度為___________(寫岀相關字母表示的代數式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知有機物A和C互為同分異構體且均為芳香族化合物,相互轉化關系如下圖所示:

請回答下列問題:
(1)寫出有機物F的有關結構簡式_________ 、_________ 、______________ 。
指出①②的反應類型:①_______________;②________________;
(2)寫出與E互為同分異構體且屬于芳香族化合物含有兩種官能團的有機物結構簡式 ___________________________________________ 。
(3)寫出發生下列轉化的化學方程式:
C→D_________________________________,
D→E______________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com